微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
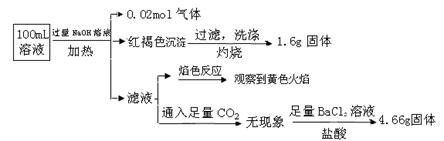
由此可知原溶液中
A.原溶液中c(Fe3+)="0.2" mol·L-1
B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1
C.SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在
D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
参考答案:B
本题解析:根据设计并完成的实验:①加入过量NaOH溶液,加热,得到0.02mol气体,说明有NH4+,而且为0.02mol。同时产生红褐色沉淀,说明有Fe3+,但由于Fe2+极易被氧化为Fe3+,所以这里不能排除原溶液中没有Fe2+存在,又由于Fe3+(或Fe2+)不能与CO32ˉ共存,所以原溶液中就没有CO32ˉ,且根据过滤、洗涤、灼烧后得1.6g固体(Fe2O3)可知Fe离子为0.02mol。②滤液焰色反应呈黄色,说明有Na+,但不能说明有原溶液中一定Na+,因为在加入过量NaOH溶液时,引入了Na+。③根据不溶于盐酸的4.66g沉淀,说明有SO42-,且为0.02mol。④根据电荷守恒可知一定有Cl-,且至少有0.02mol,因为如果原溶液中有Na+,则Cl-大于0.02mol,即c(Clˉ)≥0.2 mol·L-1。由此可知,原溶液中NH4+、 SO42ˉ、Clˉ一定存在,Fe3+或Fe2+至少有一种存在;Na+可能存在也可能不存在;CO32ˉ、Al3+一定不存在。所以,选项B正确,选项A、C、D错误。
本题难度:一般
2、选择题 在溶液中加入足量Na2O2后仍能大量共存的离子组是(?)。
A.NH4+、Ba2+、Cl-、NO3-
B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3-
D.Na+、Cl-、CO32-、SO32-
参考答案:B
本题解析:在溶液中加入Na2O2固体,Na2O2首先与水反应生成NaOH和O2,A中,NH4+和OH-因发生反应生成NH3·H2O而不大量共存;C中Ca2+、
Mg2+、HCO3-和OH-都不能大量共存;D中SO32-具有还原性,和Na2O2、O2都会发生氧化还原反应,因此答案为B。
本题难度:一般
3、选择题 向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是

A.Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)

B.Va=Vb时:c (CH3COOH) +c (H+)>c (OH-)

C.Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H)

D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
参考答案:C
本题解析:若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,则A选项正确;若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;若Va<Vb,说明碱过量,当碱液加的量足够多,则可以存在c(K+)>c(CH3COO-),C选项错误;D选项符合电荷守恒,正确。
本题难度:一般
4、选择题 对下列各种溶液中所含离子的判断合理的是







A.向无色溶液中加氯水变橙色,溶液中可能含:SO42-、Br-、OH-,Ba2+

B.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ba2+,HCO3-

C.某溶液,加铝粉有氢气放出,则溶液中可能含:K+,Na+、H+,NO3-

D.在c(H+)=10-14mol/L的溶液中可能含:Na+,AlO2-,CO32-,SO32-
参考答案:D
本题解析:略
本题难度:简单
5、选择题 下列各组离子在碱性溶液中能大量共存,且无色透明,加酸酸化后溶液变色,但无沉淀、无气体生成的是?( ?)
A.Fe2+、I-、ClO-、SO42-
B.Br-、K+、SO42-、BrO3-
C.S2-、SO42-、K+、SO32-
D.Ca2+、Cl-、H2PO4-、Na+
参考答案:B
本题解析:A、Fe2+带有颜色(浅绿),故错; B、5Br-+BrO3-+6H+=3Br2+3H2O C、加酸后有气体产生,故错; D、在碱性溶液中,3Ca2++2H2PO4-+4OH-=Ca3(PO4)2↓+4H2O,故错。
本题难度:一般