微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (12分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)? ?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
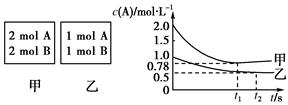
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
参考答案:(12分 (每小题3分)(1)50% (2)1 (3)2 (4)C
本题解析:(1)根据图像可知,乙中平衡时A的浓度是0.5mol/L,所以消耗A的浓度是1mol/L-0.5mol/L=0.5mol/L,则消耗B的浓度是0.5mol/L,因此乙中B的转化率是0.5÷1=50%。
(2)甲相当于在乙的基础上压缩容器容积,应用瞬间A的浓度变为原来的2倍,但最终平衡时A的浓度小于1mol/L,这说明增大压强平衡向正反应方向移动,即正反应是体积减小的,所以x只能是等于1。
(3)乙中平衡时三种物质的浓度都是0.5mol/L,所以该反应的平衡常数K=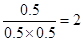
(4)向平衡后的乙容器中充入氦气,压强增大,但反应物的浓度不变,平衡不移动,A不正确;正反应是放热反应,升高温度平衡向逆反应方向移动,所以将乙容器单独升温不可能使乙容器内各物质的体积分数与甲容器内的相同,B正确;若向甲容器中再充入2 mol A、2 mol B,则相当于是在甲的基础上增大压强,平衡向正反应方向移动,所以根据勒夏特列原理可知,最终平衡时平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1。
点评:由于压强对平衡状态的影响是通过改变浓度实现的,所以在判断压强对平衡状态的压缩时,需要注意的时,压强的变化是否引起反应物的浓度变化,如果浓度不变,则即使压强增大,平衡状态也不影响。在判断时需要特别注意,需要具体问题具体分析。
本题难度:一般
2、选择题 将2.0 mol SO 气体和2.0 mol SO
气体和2.0 mol SO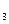 气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)
气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) ?2
?2 SO3(g),达到平衡时SO3为n mol 。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是?(?)
SO3(g),达到平衡时SO3为n mol 。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是?(?)
A.1.6 mol SO2+0.3 mol O2+0.4 mol SO3
B.3.0 mol SO2+1.0 mol O2+1.0 mol SO3
C.2.0 mol SO2+1.0 mol O2+2.0 mol SO3
D.4.0 mol SO2+1.0 mol O2
参考答案:D
本题解析:略
本题难度:一般
3、简答题 t℃时,将3mol?A?和1mol?B气体,通入体积为2L的密闭容器(容积不变),发生反应:3A(g)+B(g)?4C(g)?2min时反应达到平衡状态(温度不变),并测得C?的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始到达到平衡状态,生成C的平均反应速率为______.
(2)达到平衡状态时,B?物质的转化率α(B)=______,平衡常数K=______(填计算结果).
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡______(填字母)
A、向正反应方向移动?B、向逆反应方向移动?C、平衡不移动.
(4)若向原平衡中再充入a?mol?C,在t℃时达到新平衡,此时B的物质的量为:n?(B)=______?mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间该满足的关系为:______.
参考答案:(1)2min时反应达到平衡状态时,C?的浓度为0.4mol/L,所以v(C)=0.4mol/L2min=0.2mol/(L?min),
故答案为:0.2mol/(L?min);
(2)平衡时C?的浓度为0.4mol/L,由方程式可知B的浓度变化量为0.4mol/L×14=0.1mol/L,故B的转化率为0.1mol/L1mol2L×100%=20%,
? 3A(g)+B(g)?4C(g)
开始(mol/L):1.5? 0.5? 0
变化(mol/L):0.3? 0.1? 0.4
平衡(mol/L):1.2? 0.4? 0.4
故平衡常数k=0.440.4×1.23=127
故答案为:20%,127;
(3)容器的容积不变,通入氦气,反应混合物的浓度不变,平衡不移动,故答案为:C;
(4)根据(2)中三段式可知,平衡时B的物质的量分数为0.41.2+0.4+0.4=15,向原平衡中再充入a?mol?C,等效为开始通入(a+4)molC,恒温恒容下,该反应前后气体的体积不变,压强增大,平衡不移动,平衡时各组分的含量不变,故n(B)=(a+4)mol×15=(0.8+0.2a)mol,故答案为:0.8+0.2a;
(5)恒温恒容下,该反应前后气体的体积不变,按化学计量数转化到左边,满足n(A):n(B)=3:1即可,故n(A)+34n(C)=
3[n(B)+14n(C)],整理的n(A)=3n(B),故满足n(A)=3n(B),n(C)>0即可,故答案为:n(A)=3n(B),n(C)>0.
本题解析:
本题难度:一般
4、选择题 下列平衡体系中,升温或减压都使平衡向右移动的是 (? )
A.N2(g)+3H2(g)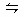 2NH3(g);ΔH<0
2NH3(g);ΔH<0
B.N2(g)+O2(g)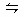 2NO(g);ΔH<0
2NO(g);ΔH<0
C.C(s)+H2O(g)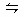 CO(g)+H2(g);ΔH>0
CO(g)+H2(g);ΔH>0
D.2SO2(g)+O2(g)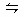 2SO3(g);ΔH<0
2SO3(g);ΔH<0
参考答案:C
本题解析:依据升高温度,平衡向吸热反应方向移动;减小压强,平衡向气体体积增大的方向移动的原理。平衡体系中升温或减压都使平衡向右移动,说明反应的特点是正反应为吸热(ΔH>0)的、气体体积增大的。故只有C选项符合。
本题难度:一般
5、选择题 一定条件下,当一个可逆反应进行到正反应速率与逆反应速率相等的时候,就达到了“化学平衡”。对于化学平衡的下列说法中正确的是
①化学反应达到化学平衡时,反应物与生成物的浓度(或含量)保持不变;
②化学反应达到化学平衡时,整个反应处于停滞状态;
③当影响化学平衡的外界条件发生改变时,化学平衡状态一定会被破坏。
A.只有①
B.只有①②
C.只有①③
D.①②③
参考答案:A
本题解析:化学平衡状态:在一定条件下,当一个可逆反应的正反应速率与逆反应速率相等时,反应物的浓度与生成物的浓度不再改变,达到一种表面静止的状态,即"化学平衡状态". 其中,正反应速率与逆反应速率相等是化学平衡状态的实质,而反应物的浓度与生成物的浓度不再改变是化学平衡状态的表现。故①正确。化学平衡状态是一个动态平衡,平衡时,反应仍在进行。故②错误。对于将各1mol氢气和碘蒸气放入固定容积密闭容器中进行反应:H2(g)+I2(g)? 2HI(g)达到平衡状态后,再加入1mol氢气和碘蒸气原平衡未破坏。故③错误。选A。
2HI(g)达到平衡状态后,再加入1mol氢气和碘蒸气原平衡未破坏。故③错误。选A。
点评:本题考查化学平衡的计算;化学平衡的影响因素等,难度不大,注意基础知识的理解掌握。
本题难度:一般