微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
A.9
B.16
C.20
D.25
参考答案:C
本题解析:
依题意得,平衡时c(HI)=4mol?L-1,HI分解生成的H2的浓度为0.5mol?L-1,NH4I分解生成的HI的浓度为4mol?L-1+2×0.5mol?L-1=5mol?L-1,故NH4I分解生成的NH3的浓度为5mol?L-1,所以反应①的平衡常数k=c(NH3)?c(HI)=5mol?L-1×4mol?L-1=20mol2?L-2。答案选C。
本题难度:一般
2、选择题 已知在某温度下的水蒸气存在下列平衡:2(H2O)3

3(H2O)2,(H2O)2

2H2O(此时(H2O)3、(H2O)2、H2O都是气体)若平衡时混合气体的平均摩尔质量为19.8g?mol-1,则H2O?在平衡混合气中的体积分数为( )
A.小于95%
B.大于95%
C.等于95%
D.小于或等于95%
参考答案:因为平衡混合气为含有(H2O)3、(H2O)2、H2O三种气体的混合气,
所以先假设气体为(H2O)2与H2O的混合气,十字交叉法得:

所以水的体积分数为16.2(16.2+1.8)×100%=90%,
假设气体为(H2O)3与H2O混合气,十字交叉法得:
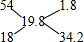
所以水的体积分数为34.2(34.2+1.8)×100%=95%,
H2O在混和气体中的体积分数为90%-95%之间,
故选A.
本题解析:
本题难度:简单
3、填空题 某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O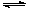 CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH="12.3" [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O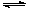 HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体, 减小
减小
d.稀释溶液,平衡常数增大
参考答案:(1)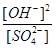
(2)碱性条件下CO2与Ca2+生成难溶物CaCO3
(3)不与Ca2+生成难溶物?酸性比碳酸弱
(4)酸性物质与OH-反应,使平衡向生成CaSO4·2H2O的方向进行? SO42-+ Ca(OH)2+2HA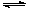 CaSO4·2H2O↓+2A- (每空2分)
CaSO4·2H2O↓+2A- (每空2分)
(5)(2分)a d
本题解析:(1)根据平衡常数表达式,该反应的平衡常数表达式K=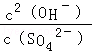 ;
;
(2)①在碱性条件下CO2与Ca2+生成难溶物CaCO3,所以不直接通入CO2;
(3)加入酸性物质,氢离子可以中和氢氧根离子,使平衡向着生成CaSO4?2H2O的方向进行;以HA表示所添加的酸性物质,由于HA酸性要小于碳酸酸性,反正方程式中应该写成分子式,所以总反应的离子方程式为SO42﹣+Ca(OH)2+2HA?CaSO4?2H2O↓+2A﹣;
(5)a.加水稀释,平衡右移溶液中CO32-,HCO3-,OH-离子的浓度都减小,但氢离子浓度增大,错误;b.通入CO2,溶液酸性增加,pH减小,正确;c.加入NaOH固体,平衡左移, 减小,正确;d.稀释溶液,平衡常数不变,错误;
减小,正确;d.稀释溶液,平衡常数不变,错误;
本题难度:一般
4、选择题 在高温下,反应2HBr(g) H2(g)+Br2(g)(正反应为吸热反应)达到平衡时,要使混合物气体的颜色加深,可采用的反应条件是(? )
H2(g)+Br2(g)(正反应为吸热反应)达到平衡时,要使混合物气体的颜色加深,可采用的反应条件是(? )
A.减小压强
B.缩小体积
C.升高温度
D.增大氢气的浓度
参考答案:BC
本题解析:要使颜色加深必须增大c(Br2)。
本题难度:简单
5、选择题 在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入?1.92g铜粉,微热,充分反应后溶液中c(Cu2+)为
A.0.15mol/L
B.0.3mol/L
C.0.225mol/L
D.无法计算
参考答案:C
本题解析:分析:铜与硝酸反应,与硫酸不反应,硫酸存在的情况下,溶液中发生离子反应3Cu+8H++2NO3-=3Cu2++2NO+3H2O,结合铜、硝酸根、氢离子的物质的量根据离子方程式进行过量计算,再根据不足的物质计算铜离子的物质的量,结合c=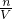 计算铜离子浓度.
计算铜离子浓度.
解答:溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=0.4mol/L×0.1L+0.1mol/L×0.1L×2=0.06mol,
n(NO3-)n=0.4mol/L×0.1L=0.04mol.1.92g铜的物质的量为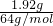 =0.03mol;
=0.03mol;
硝酸和铜反应的离子方程式如下:3Cu+8H++2NO3-=3Cu2++2NO+3H2O?
?3Cu~~~~~8H+~~~~2NO3-~~~~3Cu2+.
?3? ?8?2? 3?
0.03mol?0.08mol?0.02mol?
所以氢离子的物质的量不足,根据氢离子的物质的量计算,由离子方程式可知0.06mol氢离子反应,消耗铜的物质的量为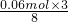 =0.0225mol;所以生成的铜离子的物质的量为0.0225mol.
=0.0225mol;所以生成的铜离子的物质的量为0.0225mol.
所以溶液中c(Cu2+)=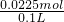 =0.225mol/L.
=0.225mol/L.
故选:C.
点评:本题考查混合物的计算,题目难度中等,根据离子方程式判断离子过量是解答本题关键.
本题难度:简单