微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
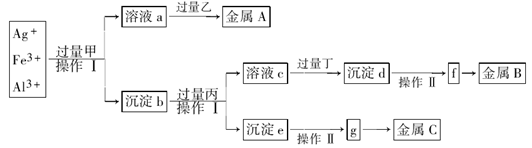
1、填空题 从含有Ag+、Fe3+和Al3+的溶液中,按下图所示方法分离提取金属单质
 ?
?
已知:实验时甲、乙、丙、丁四种物质只能从碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中选择,也可用这四种溶液来制取。对该实验过程的分析正确的是
A.丙是NaOH,丁是稀H2SO4
B.乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来
C.操作I是过滤和洗涤沉淀。洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次
D.g是氧化物,金属c采用电解法获得
参考答案:B
本题解析:向某溶液中加入碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中的一种溶液,能产生金属单质,则加入的物质应该有还原性,乙只能为葡萄糖溶液。溶液a中应该含有Ag(NH3)2+.所以甲溶液为NH3 .它是由(NH4)2CO3与NaOH共热制取的。反应的方程式为:(NH4)2CO3+2NaOH Na2CO3+ 2NH3↑ + 2H2O。沉淀b为Fe(OH)3和Al(OH)3. 由于Al(OH)3是两性物质,能够被过量的强碱溶液溶解,而Fe(OH)3不能与强碱发生反应,可以通过过滤分离开。因此丙是NaOH溶液。溶液c为NaAlO2,沉淀e为Fe(OH)3。向NaAlO2溶液中加入过量的丁产生沉淀d,因为Al(OH)3两性,只能与强酸、强碱反应,而与弱酸、弱碱吧反应,所以丁应该是CO2;沉淀d是Al(OH)3。丁是由(NH4)2CO3与H2SO4反应制取的。反应的方程式为:(NH4)2CO3+ H2SO4= (NH4)2SO4+ CO2↑ + H2O。将沉淀d过滤出来,洗涤、干燥,然后加热发生分解反应:2Al(OH)3
Na2CO3+ 2NH3↑ + 2H2O。沉淀b为Fe(OH)3和Al(OH)3. 由于Al(OH)3是两性物质,能够被过量的强碱溶液溶解,而Fe(OH)3不能与强碱发生反应,可以通过过滤分离开。因此丙是NaOH溶液。溶液c为NaAlO2,沉淀e为Fe(OH)3。向NaAlO2溶液中加入过量的丁产生沉淀d,因为Al(OH)3两性,只能与强酸、强碱反应,而与弱酸、弱碱吧反应,所以丁应该是CO2;沉淀d是Al(OH)3。丁是由(NH4)2CO3与H2SO4反应制取的。反应的方程式为:(NH4)2CO3+ H2SO4= (NH4)2SO4+ CO2↑ + H2O。将沉淀d过滤出来,洗涤、干燥,然后加热发生分解反应:2Al(OH)3 Al2O3+ 3H2O.得到固体f: Al2O3.再电解Al2O3即得到金属B:Al. 2Al2O3
Al2O3+ 3H2O.得到固体f: Al2O3.再电解Al2O3即得到金属B:Al. 2Al2O3 4Al+3O2↑.将沉淀e Fe(OH)3过滤出来,洗涤、干燥,然后加热发生分解反应:2Fe(OH)3
4Al+3O2↑.将沉淀e Fe(OH)3过滤出来,洗涤、干燥,然后加热发生分解反应:2Fe(OH)3 Fe2O3+ 3H2O.得到固体g: Al2O3.再用CO还原Al2O3即得到金属C:Fe。3CO+Al2O3
Fe2O3+ 3H2O.得到固体g: Al2O3.再用CO还原Al2O3即得到金属C:Fe。3CO+Al2O3 2Fe+ 3CO2.通过上述分析可知正确选项为B.
2Fe+ 3CO2.通过上述分析可知正确选项为B.
本题难度:一般
2、填空题 某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。

请回答下列问题。
(1)?图中涉及分离溶液与沉淀的方法是____________________________。
(2)? B、C、D、E四种物质的化学式为:
B__________、C__________、D__________、E__________。
(3) 写出下列反应的离子方程式:
沉淀F与NaOH溶液反应________________________________。
沉淀E与稀硫酸反应____________________________。
溶液G与过量稀氨水反应________________________________。
参考答案:(1) 过滤?(2) B:? Al2O3? C:? Fe2O3? D:? NaAlO2? E: Al(OH)3
(3) Al2O3+2OH-=AlO2-+H2O; Al(OH)3+3H+=Al3++3H2O;Al3++3NH3·H2O=3NH4++Al(OH)3↓
本题解析:Al2(SO4)3、Al2O3和Fe2O3中Al2(SO4)3溶于水,Al2O3溶于NaOH,可确定B:? Al2O3? C:? Fe2O3? D:? NaAlO2? E: Al(OH)3。
本题难度:一般
3、选择题 图4-1表示相同质量的Mg、Al分别跟一定量的稀H2SO4溶液反应的情况,下列叙述可能符合(图4-1)图示的有(?)
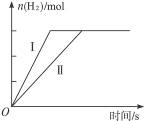
图4-1
A.Mg、Al均过量
B.Mg、Al都恰好跟酸完全反应
C.Mg过量而Al恰好跟酸完全反应
D.Al过量而Mg恰好跟酸完全反应
参考答案:AD
本题解析:Mg比Al活泼,Mg与酸反应的速率快于Al与酸反应的速率。图Ⅰ为Mg的图象,图Ⅱ为Al的图象。根据图象分析,最终生成的氢气的量相同,而同质量的镁、铝完全反应,铝生成的氢气的量要多一些,所以Al过量而Mg恰好跟酸完全反应。答案为A、D。
本题难度:简单
4、选择题 在实验室中,用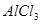 溶液制备
溶液制备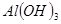 沉淀,最好选用的试剂是
沉淀,最好选用的试剂是
A.石灰水
B.氢氧化钠溶液
C.硫酸
D.氨水
参考答案:D
本题解析:氯化铝要制备氢氧化铝,则需要加入碱液。由于氢氧化铝是两性氢氧化物,既能和酸反应,又能和碱反应。因此选择的碱不能是强碱,最好是弱碱氨水,答案选D。
点评:该题是中等难度的试题,侧重考查学生对氢氧化铝性质以及制备的连接掌握情况,难度不大。明确制备原理和氢氧化铝的两性是答题的关键。
本题难度:简单
5、选择题 将ag Mg、Al合金完全溶解在V1L、c1mol/L的盐酸溶液中,产生bgH2。再向反应后的溶液中加入V2L,c2mol/LNaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg。则下列关系式错误的是(? )
A.合金中的物质的量为(24b-a)/9mol
B.d=a+17b
C.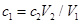
D.与金属反应后剩余盐酸的物质的量浓度为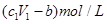
参考答案:A、D
本题解析:A、设n(Mg)=xmol, n(Al)=ymol,
则有:24x+27y=a;x+1.5y=b/2
解之得:


B、生成的沉淀的质量为氢氧化镁跟氢氧化铝的质量的和:也等于镁和铝的质量再加上氢氧根离子的质量,而氢氧根离子的质量在这里等于氢氧根离子的物质的量那氢氧根离子的摩尔质量之积,氢氧根离子的物质的量等于在这个反应过程中镁跟铝反应时所失去的电子的物质的量,又等于反应过程中酸中的氢所得到的电子的物质的量,也就是说氢氧根离子的物质的量等于氢气的物质的量的二倍。所以有如下关系:d=a+17b
C、在这个过程中后边加的氢氧化钠可以理解为是刚好跟前面加的盐酸进行中和反应。因此它们二者的物质的量相等,有: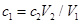
D、与金属反应后剩余盐酸的物质的量浓度为:
本题难度:一般