微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在某温度下,可逆反应m A (g)+n B (g) 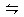 p C(g)+q D(g)的平衡常数为K,下列说法不正确的是 (? )
p C(g)+q D(g)的平衡常数为K,下列说法不正确的是 (? )
A.K越大,达到平衡时,反应进行的程度越大
B.K的表达式是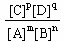
C.K随反应物浓度的改变而改变
D.K随温度的改变而改变
2、选择题 在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)(mol·L-1·s-1)表示,且v(A)、v(B)、v(C)之间有如下所示的关系:v(B)=3v(A);3v(C)=2v(B)。则此反应可表示为
[? ]
A.2A+3B=2C
B.A+3B=2C
C.3A+B=2C
D.A+B=C
3、填空题 (14分)能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g)?△H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g)?△H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g)?△H=-393.5 kJ · mol-1
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是_____________(填字母序号)。
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
 CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下: