| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《原子核外核外电子排布与表示》高频试题特训(2017年最新版)(二)
(4)某种由氧和钾元素形成的化合物,其晶胞结构如右图所示,该晶体的化学式为______. 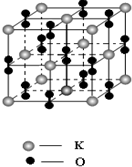 参考答案:(1)第二周期元素形成的氧化物分子有:CO,CO2,NO、NO2、SO2、SO3等、满足要求的是:O=C=O,有2个σ键和2个π键,由于CO2?是直线型分子,故C原子采取sp?杂化;由于OF2的分子构型与H2O相似,H2O的分子构型为V形,所以OF2的分子构型V形,由于同一周期,从左到右,元素的电负性逐渐增大,所以氮的电负性<氧的电负性,由于氧原子半径比氮原子小,吸S电子能力较强,故氧的电负性大;? 本题解析: 本题难度:一般 3、选择题 下列各原子或离子的电子排布式错误的是 参考答案:B 本题解析: 本题难度:简单 4、选择题 2005年有科学家在《Science》上发表论文,宣布发现铝的超原子结构Al13和?Al14,并在质谱仪检测到稳定的Al13-和Al142+等.Al13、Al14的性质很像现行周期表中某些主族元素,已知当这类超原子具有40个价电子时最稳定.下列说法不正确的是( ) 参考答案:A、“超级原子”最外层电子数之和为40个时处于相对稳定状态,Al13有39个价电子极易得一个电子成稳定的Al13-,与第七主族性质相似,故A正确; 本题解析: 本题难度:简单 5、填空题 (1)原子轨道:把电子出现的概率约为________的空间圈出来,所得到的电子云轮廓图形称为原子轨道。 参考答案:(1)90% 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《氧化还原反.. | |