微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 原子序数为1-18号的元素中,下列叙述正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是金属元素
D.核电荷数为17的元素的原子在化学反应中容易得到1个电子
参考答案:CD
本题解析:
本题难度:一般
2、选择题 Na和Na+含有相同的( )
A.质子数
B.电子数
C.电子层数
D.最外层电子数
参考答案:A、Na失去最外层的一个电子变为Na+,核内质子数不变,故A正确;
B、Na失去一个电子变为Na+,核外电子数减少了1个,故B错误;
C、Na失去一个电子变为Na+,电子层数由3层变成2层,故C错误.
D、Na失去一个电子变为Na+,最外层电子数与1变成了8,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 某元素原子的次外层有2个电子,其最外层差一个电子即达稳定结构,该元素是( )
A.Na
B.Cl
C.F
D.H
参考答案:元素原子的次外层有2个电子,即K层排满了两个电子,最外层差一个电子即达稳定结构,即最外层电子数是7,所以该元素是F.
故选C.
本题解析:
本题难度:一般
4、选择题 下列关于多电子原子核外电子的运动规律的叙述中正确的是
[? ]
A.核外电子是分层运动的
B.所有电子在同一区域里运动
C.能量高的电子在离核近的区域运动
D.能量低的电子在离核近的区域绕核旋转
参考答案:AD
本题解析:
本题难度:简单
5、简答题 如图为周期表的一部分,其中的编号代表对应位置的元素.请回答下列问题:
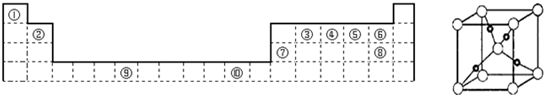
(1)写出表中元素⑨原子的核外电子排布式______.
(2)元素④、⑤的第一电离能大小顺序是:______>______;(用元素符号表示,下同)元素⑥、⑧电负性大小顺序是:______>______
(3)元素③、⑧形成的化合物中心原子杂化轨道类型:______,分子的空间构型______
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的化学方程式______
(5)如图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为______.
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的结构类似,但NF3?不易与Cu2+形成配离子,其主要原因是:______.
参考答案:(1)由元素在周期表中的位置可知,⑨是26号Cr元素,核外电子排布式为1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(2)④是N元素,⑤是O元素,N元素2p能级有3个电子,处于半满稳定状态,能量较低,失去第一个电子需要能量更多,故第一电离能N>O,
⑥是F元素,⑧Cl元素,同主族自上而下电负性减小,故电负性F>Cl;
故答案为:N;O;F;Cl;
(3)③是C元素,⑧Cl元素,二者形成物质为CCl4,C原子成4个C-Cl键,不含孤电子对,杂化轨道数为4,杂化方式为sp3,为正四面体结构,故答案为:sp3;正四面体;
(4)②是Be元素,⑦是Al元素,二者性质相似,根据Al与氢氧化钠的反应可知,故Be(OH)2与氢氧化钠溶液反应生成Na2BeO2、H2O,反应方程式为Be(OH)2+2NaOH═2H2O+Na2BeO2,
故答案为:Be(OH)2+2NaOH═2H2O+Na2BeO2;
(5)⑩是Cu元素,晶胞中顶角和体心是氧原子,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,晶胞中含有O原子数目为1+8×18=2,故Cu原子与O原子数目之比为4:2=2:1,该氧化物化学式为Cu2O,故答案为:Cu2O;
(6)NF3分子中氟原子电负性强,吸引孤对电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键,故答案为:NF3分子中氟原子电负性强,吸引电子能力强.
本题解析:
本题难度:一般