|
高中化学必备知识点《难溶电解质的溶解平衡》高频试题强化练习(2017年最新版)(八)
2017-09-23 22:49:44
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)对于Ag2S(s) 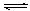 2Ag+(aq)+ S2-(aq),其Ksp=____________。 2Ag+(aq)+ S2-(aq),其Ksp=____________。
(2)下列说法不正确的是__________。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
C.对于Al(OH)3(s) 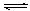 Al(OH)3(aq) Al(OH)3(aq) 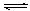 Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡;
D.除溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
| E. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
参考答案:(1)[c(Ag+)]2·c(S2-)?(2)BD
本题解析:(1)溶度积常数是在沉淀达到溶解平衡时,电解质电离出都离子浓度的幂之积,所以根据方程式可知该溶度积常数是Ksp=[c(Ag+)]2·c(S2-)?。
(2)盐酸中氯离子浓度大,所以抑制氯化银的溶解平衡,因此用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,A正确;有些物质的溶解是放热的,例如氢氧化钠,B不正确;C正确,D不正确,因为沉淀转化的方向一般是向生成更难溶的方向转化,所以Mg(OH)2的溶解度比MgCO3小;根据勒夏特例原理可知,选项E正确,所以答案选BD。
点评:沉淀溶解平衡也是一种动态平衡,所以在分析外界条件对平衡状态的影响时,应该利用勒夏特例原理进行。
本题难度:一般
2、选择题 一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的溶度积。在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知有关物质的颜色和溶度积如下

下列叙述不正确的是
[? ]
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
C.若先加入足量Na2S溶液,再加入KI溶液,则无黄色沉淀产生
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列属于微溶物质的是 ( )
A.AgCl
B.BaCl2
C.CaSO4
D.Ag2S
参考答案:C
本题解析:本题考查的内容属于简单的识记性知识,选项C符合题意。
本题难度:简单
4、填空题 将AgCl分别投入下列溶液中:
①20ml 0.1mol/L的(NH4)2CO3溶液
②40ml 0.03mol/L的HCl溶液
③50ml 0.03mol/L的AgNO3溶液
④30ml 0.02mol/L的CaCl2溶液
⑤10ml 蒸馏水
⑥30ml 0.2mol/L的NH4NO3溶液
AgCl的溶解度由大到小的顺序是————
参考答案:
①>⑥>⑤>②=③>④
本题解析:
在水中AgCl存在溶解平衡(注:第一个方程式是双向箭头)
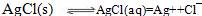
(注:s表示为溶解的固体,aq表示已被溶解,但未电离的AgCl)
当溶液中存在Ag+或者 时,溶解平衡逆向移动,AgCl的溶解度减小。溶液中Ag+和 时,溶解平衡逆向移动,AgCl的溶解度减小。溶液中Ag+和 的浓度越大,逆向移动的程度越大,溶解度就越小。 的浓度越大,逆向移动的程度越大,溶解度就越小。
以中性的水为参照,溶解度5>2="3>4"
又由于有反应:(注:双向)
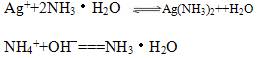
说明溶液碱性越强,NH4(+)的浓度越大,银离子越容易被消耗,AgCl的溶解度也越大。由于作为弱酸弱碱盐的(NH4)2CO3的PH值显然大于强酸弱碱盐的NH4NO3,所以与水比较有1>6>5
综上所述:1>6>5>2=3>4
本题难度:简单
5、选择题 根据下图溶解度曲线,在恒定70℃将物质的量浓度相等的硝酸钠溶液和氯化钾溶液等体积混合降温至25℃,首先析出的是

A.氯化钠
B.硝酸钠
C.氯化钾
D.硝酸钾
参考答案:D
本题解析:
正确答案:D
NaNO3与KCl混合后,溶液中的四种离子将重组, NaNO3+KCl=KNO3↓+NaCl,降温至25℃,KNO3溶解度变化最大,饱和从溶液中析出。
本题难度:简单
|