微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 除去下列括号内杂质所选试剂不正确的是?(?)
A.SO2(HCl)饱和NaHSO3溶液
B.Fe(Al) NaOH溶液
C.CO2(CO)灼热CuO
D.Cl2(H2O)碱石灰
参考答案:D
本题解析:A、HCl可以与NaHSO3溶液反应生成氯化钠和二氧化硫,正确;B、铝可以与氢氧化钠反应生成偏铝酸钠,正确;C、一氧化碳和氧化铜反应生成二氧化碳和铜单质,正确;D、氯气可以与碱石灰发生反应,错误。
本题难度:一般
2、填空题 (10分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂志,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)判断BaCl2已过量的方法是?。
(2)第④步中,相关的例子方程式?。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是?。
(4)为检验精盐纯度,需配制200ml0.1mol/LnaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是?。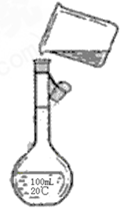
参考答案:(1)取第②步后的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
(2)Ca2+ + CO32- = CaCO3↓;? Ba2+ + CO32-= BaCO3↓
(3)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
(4)①容量瓶不是200ml的,②没有用玻璃棒引流。
本题解析:(1)检验氯化钡过量的方法是继续滴加氯化钡溶液,即取第②步后的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
(2)加入的碳酸钠用来除去钙离子以及过量的钡离子,方程式为Ca2+ + CO32- = CaCO3↓;? Ba2+ + CO32-= BaCO3↓。
(3)如果先加盐酸再过滤,则盐酸能溶解沉淀从而影响制得精盐的纯度。
(4)根据装置图可知,主要错误是①容量瓶不是200ml的,②没有用玻璃棒引流。
本题难度:一般
3、实验题 发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾[KAl(SO4)2?12H2O]中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由__________________________组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
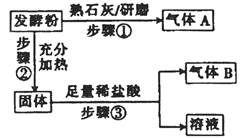
(2)结合步骤①~③分析,气体A为________,该发酵粉的成分为__________________。
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液,观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由:________________,? ____________________________________________________________________。
(4)乙品牌的发酵粉的化学组成可能为假设2情况,请设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1 mol/LNaOH溶液,写出实验步骤、预期现象和结论。
实验步骤
| 预期现象和结论
|
步骤1:取少量样品溶于足量的盐酸后,
将溶液分成两份,分别装入A、B试管中。
| ?
|
步骤2:_____________________________
__________________________________
| ?________________________证明有Na+,发
酵粉中有NaHCO3。
|
步骤3:_____________________________
___________________________________
| ___________________________________
_______,结合步骤2中的结论,假设2成立。
|
?
参考答案:(16分)(1)臭粉和明矾(2分)
(2)氨气(或NH3)(2分)? NaHCO3和NH4HCO3(2分,写名称也给分)
(3)不能(1分),因为加热NaHCO3分解成Na2CO3,Na2CO3和明矾都能与BaC12溶液反应生成白色沉淀。(2分)?注:意思接近也得分
(4)(7分)
步骤2:用洁净的铂丝蘸取A中的溶液,在
酒精灯外焰上灼烧,观察焰色(2分)
焰色呈黄色(1分)
步骤3:【方法1】向B试管中逐滴滴加
0.1 mol/L NaOH溶液(2分)
看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解)(1分),证明发酵粉中有明矾。(1分)
?
【方法2】再蘸取A中的溶液(或蘸取B溶液),在酒精灯外焰上灼烧(1分),透过蓝色钴玻璃观察(1分)?焰色呈紫色(1分),证明发酵粉中含有明矾(1分)
注:步骤2中,“用洁净的铂丝蘸取待测液”得1分,“在酒精灯火焰上灼烧”得1分。
只写“蘸取待测液”该给分点不得分,“在酒精灯、酒精喷灯火焰上灼烧”都给分。
步骤3中,若用焰色反应方法,不用洗涤铂丝。若用NaOH溶液检验,“0.lmol/L NaOH
溶液”得1分,“逐滴滴加”得1分。
本题解析:(1)根据题意可知,不同品牌的发酵粉可能小苏打和臭粉组成,也可能由小苏打和明矾组成,还可能由臭粉和明矾组成,根据已知的假设1、假设2推断假设3为臭粉和明矾;(2)根据NaHCO3、NH4HCO3、Al2(SO4)2?12H2O的主要性质可知,NH4HCO3是铵盐,与熟石灰混合研磨可以放出氨气,其余两种盐与熟石灰研磨都不能放出气体,则A为NH3,发酵粉甲一定含有臭粉;NH4HCO3固体充分加热后完全变为气体逸出,NaHCO3固体充分受热变为Na2CO3固体和CO2、H2O,Na2CO3固体与盐酸易反应生成二氧化碳气体、NaCl、H2O,而Al2(SO4)2?12H2O或其水解产物Al(OH)3与盐酸混合都无气体产生,由此推断B为CO2,该发酵粉一定含有小苏打,所以甲品牌的发酵粉的主要成分是NaHCO3、NH4HCO3;(3)Ba(OH)2既能与硫酸盐反应,生产白色的硫酸钡沉淀,也能与碳酸盐反应,生成白色的碳酸钡沉淀,因此不能确定发酵粉中含有明矾还是小苏打;(4)根据实验方案中步骤2的结论逆推可知,步骤2是用洁净的铂丝蘸取A中的溶液,再酒精灯外焰上灼烧,火焰的颜色呈黄色,证明有Na+,发酵粉中有NaHCO3;由于假设2是发酵粉由小苏打和明矾组成,则步骤3的结论是证明发酵粉有Al2(SO4)2?12H2O,根据其性质及提供试剂的性质推断,步骤3是设计实验方案证明发酵粉中含有Al3+,因此应向B试管中逐滴滴加0.1mol/LNaOH溶液,观察到白色沉淀或先产生白色沉淀后沉淀溶解,证明有Al3+,发酵粉中有明矾。
本题难度:困难
4、选择题 从海藻灰中提取碘的方法是:往海藻灰浸取液中通入Cl2后用升华的方法将置换的碘提纯。但浸取液中通入Cl2时会生成少量性质类似于Cl2的ICl和IBr,为了消除这两种杂质,使其中的碘完全游离出来,可加入适量的
[? ]
A.CaO
B.KI
C.H2O
D.酒精
参考答案:B
本题解析:
本题难度:一般
5、选择题 除去Fe2O3固体中少量的Al2O3杂质,可选用的试剂是( )
A.稀盐酸
B.NaOH溶液
C.氨水
D.稀硝酸
参考答案:Fe2O3和Al2O3都可与酸反应,则不能用盐酸和硝酸除杂,Al2O3为两性氧化物,可与强碱溶液反应,则可用氢氧化钠溶液分离,易都不氨水反应,则不能用氨水分离,
故选:B.
本题解析:
本题难度:一般