微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
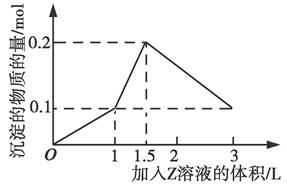
1、选择题 1 L某混合溶液中,溶质X、Y的浓度都为0.1 mol/L,向混合溶液中滴加某溶液Z(0.1 mol/L的氢氧化钠或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化关系如图所示,则X、Y、Z分别是(?)
A.AlCl3、FeCl3、NaOH
B.AlCl3、MgCl2、NaOH
C.NaAlO2、Ba(OH)2、H2SO4
D.NaAlO2、BaCl2、H2SO4
参考答案:C
本题解析:若X、Y、Z分别为AlCl3、FeCl3、NaOH,则沉淀的量在加入6 L NaOH时才能达到最大值0.2 mol,A错;若X、Y、Z分别为AlCl3、MgCl2、NaOH,则沉淀的量在加入5 L NaOH时达到最大值0.2 mol,B错;若X、Y、Z分别为NaAlO2、Ba(OH)2、H2SO4,滴加硫酸时先与Ba (OH)2反应,生成BaSO4沉淀和水,然后和NaAlO2依次发生反应:AlO2-+H++H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,C正确;若X、Y、Z分别为NaAlO2、BaCl2、H2SO4,起始时即生成BaSO4沉淀和Al(OH)3沉淀,结合反应方程式知,当加入0.5 L H2SO4时,AlO2-完全反应,生成0.1 mol Al(OH)3沉淀和0.5 mol BaSO4沉淀,继续加入H2SO4,生成BaSO4沉淀的同时Al(OH)3又溶解,故沉淀的最大值不可能为0.2 mol,D错
点拨:本题考查元素化合物知识,考查考生的分析、理解能力。难度中等。
本题难度:一般
2、选择题 对氧化铝的分类中正确的是
A.酸性氧化物
B.碱性氧化物
C.两性氧化物
D.不成盐氧化物(像CO一样)
参考答案:C
本题解析:由于氧化铝既能与酸反应产生盐和水,又能与碱反应产生盐和水,所以氧化铝属于两性氧化物。
本题难度:简单
3、选择题 下列金属中,遇到盐酸或强碱溶液都能放出氢气的是( )
A.Cu
B.Mg
C.Fe
D.Al
参考答案:A、铜与盐酸、强碱溶液不不反应,故A不符合;
B、镁与盐酸反应产生氢气,与强碱不反应,故B不符合;
C、铁与盐酸反应产生氢气.与强碱不反应,故C不符合;
D、铝与盐酸反应生成氯化铝和氢气,与强碱生成偏铝酸盐与氢气,故D符合.
故选D.
本题解析:
本题难度:简单
4、选择题 铝能用于冶炼难熔的金属(如钒、铬、锰等),这是因为铝具有的性质为
[? ]
A.金属性和非金属性 ?
B.导电性 ?
C.熔点低 ?
D.还原性,在冶炼反应中放出大量热
参考答案:D
本题解析:
本题难度:简单
5、选择题 某同学研究铝及其化合物的性质时设计了如下两个实验方案。
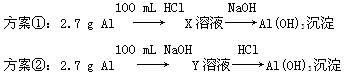 ?
?
NaOH和HCl的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是(? )
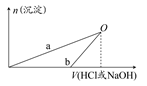
A.b曲线表示的是向X溶液中加入NaOH溶液
B.在O点时两方案中所得溶液浓度相等
C.a、b曲线表示的反应都是非氧化还原反应
D.X溶液显酸性,Y溶液呈碱性
参考答案:A
本题解析:选A。n(Al)=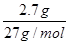 =0.1 mol,100 mL盐酸中n(H+)=0.1 L×3 mol/L=0.3 mol,100 mL NaOH溶液中n(OH-)=0.1 L×3 mol/L=0.3 mol。
=0.1 mol,100 mL盐酸中n(H+)=0.1 L×3 mol/L=0.3 mol,100 mL NaOH溶液中n(OH-)=0.1 L×3 mol/L=0.3 mol。
由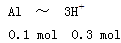 知方案①中X为AlCl3,向其中加入NaOH立即生成沉淀,图像为曲线a,由
知方案①中X为AlCl3,向其中加入NaOH立即生成沉淀,图像为曲线a,由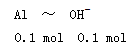 知方案②中Y为NaOH和NaAlO2的混合物,向其中加入HCl,先发生H++OH-=H2O,开始无现象,后来产生沉淀,图像为曲线b,A项错误。O点时Al3+完全沉淀,溶质只有NaCl,由于开始时n(HCl)=n(NaOH)。n(NaCl)相同,B项正确。a、b曲线反应都是复分解反应,C项正确。AlCl3溶液中由于Al3+水解,溶液显酸性,D项正确。
知方案②中Y为NaOH和NaAlO2的混合物,向其中加入HCl,先发生H++OH-=H2O,开始无现象,后来产生沉淀,图像为曲线b,A项错误。O点时Al3+完全沉淀,溶质只有NaCl,由于开始时n(HCl)=n(NaOH)。n(NaCl)相同,B项正确。a、b曲线反应都是复分解反应,C项正确。AlCl3溶液中由于Al3+水解,溶液显酸性,D项正确。
本题难度:一般