微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关实验的说法正确的是
A.除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤
B.不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液
C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.某溶液加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液一定含有大量CO32-
参考答案:B
本题解析:A错,铁与铜均能与浓硫酸加热反应;B正确;C错,制备Fe(OH)3胶体方法为向沸腾的蒸馏水中逐滴滴入饱和的氯化铁溶液5到6滴,继续加热煮沸至溶液呈红褐色为止停止加热得到氢氧化铁胶体;D错,某溶液加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中可能有CO32-或HCO3—
本题难度:一般
2、选择题 下列有关实验操作不正确的是 (?)
A.中和热的测定实验中用到的玻璃仪器有温度计、烧杯、环形玻璃搅拌棒
B.滴定管在使用前必须检验是否漏水
C.某次滴定后滴定管的读数为20.3ml
D.碱式滴定管不能量取盐酸的体积
参考答案:C
本题解析:滴定管的读数到0.01ml,选项C不正确,其余选项都是正确的,答案选C。
点评:该题是基础性试题的考查,难度不大。化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:简单
3、选择题 以下是一些常用的危险品标志,存放氢氧化钠的容器应贴的标签是(?)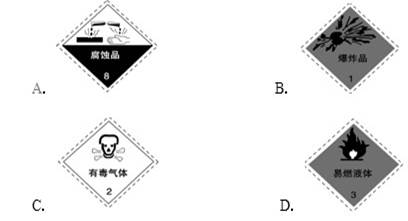
参考答案:A
本题解析:考查常见的危险品标志的识别与判断。氢氧化钠极易很强的腐蚀性,所以选项A正确,答案选A。
本题难度:简单
4、实验题 利用右图所示,根据以下8种气体回答:①H2;②O2;③CH4;④HCl;⑤NH3;⑥CO2;⑦H2S;⑧SO2。

(1)若烧瓶是干燥的,则由B口进气可收集的气体是___________,由A口进气可收集的气体是_____________。
(2)若在烧瓶内充满水,可收集的气体有______________,气体应从_____口进入。
(3)若在烧瓶中加入适量的浓硫酸,可以用它来干燥的气体有______________,气体应从__________口进入。?
参考答案:(1)②④⑥⑦⑧ (2分)?①③⑤?(2分) (2)①②③?(2分)? A?(1 分)
(3)①②③④⑥⑧?(2分)? B?(1 分)
本题解析:(1)若烧瓶是干燥的,则由B口进气可收集气体,这说明气体的密度应该是大于空气的,答案选②④⑥⑦⑧;反之由A口进气可收集的气体是密度小于空气的,答案选①③⑤。
(2)若在烧瓶内充满水,可收集的气体应该是难溶于水的,因此答案选①②③。此时气体应从A口进入。
(3)若在烧瓶中加入适量的浓硫酸,浓硫酸具有强氧化性,且显酸性,所以可以用它来干燥的气体有①②③④⑥⑧,氨气和H2S不能用浓硫酸干燥。此时气体应从B口进入。
点评:常见气体的收集方法是:1.排水法,适用于不易溶于水的气体。例如氢气,氧气;2.向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气;3,向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气。需要学生熟练记住。并能灵活运用。
本题难度:一般
5、选择题 碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为?L,石灰石中碳酸钙的质量分数为?%.
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为?.
(3)第③步反应一般不采用通入CO2的主要原因是?,相应的离子方程式为?.
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是?.
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:

与前一方案相比较,该方案的优点是?.
参考答案:(每空2分,共14分)
(1)2.24×107L ;?90.0?(4分)
(2)CaSiO3?(2分)
(3)通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解 (2分)
CaCO3+CO2+H2O=Ca2++2HCO3—?(2分)
(4)5.6×105mol/L?(2分)
(5)不需要加热,操作简单,减少来自燃料的污染(2分)
本题解析:
(1) 根据碳酸钙分解:
根据碳酸钙分解:
CaCO3 CaO? + ?CO2 ↑?△m
CaO? + ?CO2 ↑?△m
100? 56? 22.4 ?44
100×106g?V ?44×106g
所以生成二氧化碳的体积为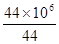 mol×22.4L/mol=2.24×107L
mol×22.4L/mol=2.24×107L
石灰石中碳酸钙的质量分数为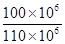 ?×100%=90.9%
?×100%=90.9%
(2)碳酸钙除了分解,还与少量杂质SiO2发生反应:SiO2+CaCO3=CaSiO3+CO2
所以不溶液性滤渣的成分有CaSiO3。
(3)因CO2过量时,会继续与碳酸钙反应,CaCO3+CO2+H2O═Ca2++2HCO3-(4)当溶液中QC≥KSP时,形成沉淀,C(Ca2+)≥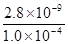 mol?L-1=2.8×10-5mol?L-1,
mol?L-1=2.8×10-5mol?L-1,
等体积混合前CaCl2溶液的物质的量浓度最小为5.6×10-5?mol?L-1
(5)因与前一方案相比较,可知制备过程不需要加热、操作简便等。
本题难度:一般