微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol?Cu2?(OH)2CO3后恰好恢复到电解前的状态(不考虑二氧化碳的溶解)则电解过程中共转移的电子数为( )
A.0.4mol
B.0.5mol
C.0.6mol
D.0.8mol
参考答案:电解硫酸铜时,初阶段:2CuSO4+2H2O?通电?.?2Cu↓+O2↑+2H2SO4,后阶段:2H2O?通电?.?2H2↑+O2↑,
如果只按照第一阶段的电解,反应只需要加入CuO或CuCO3就可以,但是现在加入的是Cu2(OH)2CO3,相当于多加入了一个水(0.1molH2O),这0.1mol的水,应该是第二阶段的反应进行,该阶段转移了0.4mol电子,第一阶段转移了0.2mol电子,所以总共转移电子0.6mol.
故选C.
本题解析:
本题难度:一般
2、选择题 下列金属适合用电解法冶炼的是:
A.铁
B.银
C.锌
D.铝
参考答案:D
本题解析:略
本题难度:简单
3、选择题 用石墨作电极电解+n价金属的硝酸盐溶液,当阴极上析出mg金属时,阳极上产生560mL(标准状况)气体,此金属的相对原子质量应为( )
A.10n
B.10m
C.10mn
D.40mn
参考答案:阳极电极反应:4OH-=4e-+2H2O+O2↑,当产生0.56L即0.025moL氧气,共发生0.1mol电子转移,在阴极是金属阳离子得电子生成金属的过程,由发生电极反应:Mn++ne-=M,再根据电子守,则转移0.1mol电子析出金属M的物质的量为0.1nmol,设相对原子质量是x,则0.1n×x=m,解得x=10mn.
故选C.
本题解析:
本题难度:简单
4、填空题 如下图所示,A、E为石墨电极,B、F为铁片电极。按要求回答下列问题。

(1)打开K2,合并K1。B为?极,A的电极反应为?,?最终可观察到的现象是?,
涉及的化学反应方程式有:?
?。
(2)打开K1,合并K2。
F为?极,F极的电极反应为?,
电解过程中,观察到溶液的现象是?。
参考答案:(1)负? O2 + 2H2O + 4e- = 4OH-?溶液中有红褐色沉淀生成2Fe+ O2 +2H2O =2Fe(OH)2? 4Fe(OH)2 + O2 +2H2O= 4Fe(OH)3
(2)阳?Fe-2e-=Fe2+?在U型管中间区域先出现白色沉淀,迅速出现灰绿色,最终出现红褐色。
本题解析:(1)打开K2,合并K1,形成原电池,由于此溶液呈中性,故属于电化腐蚀中的吸氧腐蚀。
(2)打开K1,合并K2,形成电解池,由于铁作阳极,本身失电子,即Fe-2e-=Fe2+, 阴极电极反应式:2H+ +2e-=H2↑,破坏了水的电离平衡,使溶液呈碱性,会发生下列反应:Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2 + O2 +2H2O= 4Fe(OH)3
本题难度:一般
5、选择题 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
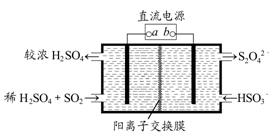
A.a为直流电源的负极
B.阴极的电极反应式为:2HSO3-+2H++e-=S2O42-+2H2O
C.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
参考答案:C
本题解析:A、从反应物和产物化合价判断,左边硫的化合价从+4价到+6价,化合价升高失去电子为阳极,a为正极,错误;B、电子数目不对,电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O,错误;C、正确;D、电解时阳离子向阴极移动,阴离子向阳极移动,错误。
本题难度:一般