微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)
(1)电解精炼铜阳极的主要反应是?,还会发生的反应有?(任写一个)。
(2)电解精炼铜的阳极泥中含有铜和金、银等贵重金属及稀有金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
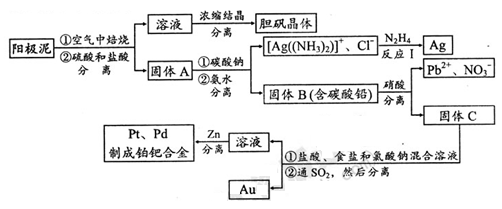
请回答下列问题:
①各步生产流程中都涉及了同一种分离方法,实验室中不能用这种方法来分离液态胶体中分散质与分散剂的原因是?。
②用硝酸处理固体B中碳酸铅的离子方程式是?。
③反应I中肼(N2H4)的作用是?。
④固体C用盐酸、食盐和氯酸钠混合溶液处理后得到H2PtCl6、AuCl3、PdCl2。反应中每消耗lmol氧化剂要转移?mol e-;在AuCl3溶液中通入SO2生成单质金,当生成19.7gAu时,25℃和101kPa下反应消耗?L SO2(此条件下的气体摩尔体积为24.5L/mol)。
参考答案:(1)Cu-2e-=" Cu" 2+、Fe-2e-=" Fe" 2+、Ni-2e-=" Ni" 2+、Zn-2e-=" Zn" 2+(各2分)
(2)①胶体中各微粒均可通过滤纸孔隙(2分)
②PbCO3+2H+=Pb2++CO2↑+H2O(2分)
④还原剂(1分)③6、(2分)3.675(3分)
本题解析:粗铜中含金、银、铁、镍、锌等杂质,电解时铜、铁、镍、锌被氧化,金、银作为阳极泥而沉淀下来;上述各流程均用到过滤操作,而胶体中各微粒均可通过滤纸孔隙,所以不能用过滤来分离液态胶体中分散质与分散剂;整个流程首先通过煅烧将铜最终变为胆矾;固体A含氯化银、硫酸铅、金、稀有金属等,用碳酸钠将硫酸铅转化为碳酸铅,再用硝酸溶解而将铅分离(这里用到沉淀的生成、转化、溶解),用氨水溶解氯化银变为银氨溶液,最后用N2H4将其还原为银;固体C含金、稀有金属等,用盐酸、氯化钠、氯酸钠等将它们溶解得到H2PtCl6、AuCl3、PdCl2,可知1mol氯酸钠被还原为Cl-转移电子6mol;用SO2将AuCl3还原而分离,根据氧化还原反应得失电子数相等知3n(Au)=2n(SO2), n(SO2)=1.5x19.7/197=0.15mol,体积为0.15 x 24.5=3.675;H2PtCl6、PdCl2用锌还原得Pt、Pd合金。
本题难度:一般
2、填空题 (16分)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,
总反应为:2CH3CHO + H2O ="==" CH3CH2OH + CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。

(1)若以甲醇燃料电池为该电解的直流电源,燃料电池中的电解液是氢氧化钠溶液,则燃料电池中b极的电极反应式为 。电池工作一段时间后,氢氧化钠溶液物质的量浓度 (填变大,变小或不变)
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。阳极电极反应如下:① 4OH- - 4e-="=" O2↑+ 2H2O;②
(3)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
(4)若直流电源使用新型的熔融碳酸盐燃料电池(MCFS),该电池以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。
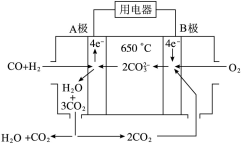
①B极发生______(填“氧化”或“还原”)反应,电极反应式 。
②以此电池电解足量的CuSO4溶液,当电池消耗1.12L(标准状况下)氧气时,则阴极产物的质量为_ _____ g。加入一定量的 可以让CuSO4溶液回复原状。
A、CuO B、Cu(OH)2 C、CuCO3 D、Cu
参考答案:(1)CH4O-6e- +8 OH- ="=" CO32-+6H2O 变小 (2)② CH3CHO -2e- + H2O ="=" CH3COOH + 2H+
(3)蒸馏 (4)①还原 O2+ 2CO2+4e-==2CO32- ② 6.4 AC
本题解析:
试题解析:(1)由图示可知,a连阳极,b连阴极,所以b为负极,若以甲醇燃料电池为该电解的直流电源,燃料电池中的电解液是氢氧化钠溶液,则燃料电池中b极的电极反应式为CH4O-6e- +8 OH- ="=" CO32-+6H2O,由电极反应可得,氢氧化钠参与反应,电池工作一段时间后,氢氧化钠溶液物质的量浓度变小;(2)阳极发生氧化反应,生成乙酸和氧气,电极反应为CH3CHO-2e-+H2O
本题难度:困难
3、选择题 把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将
所得溶液用石墨电极进行电解,阳极生成的物质是( )
A.H2
B.Ag
C.Cl2
D.O2
参考答案:D
本题解析:将等物质的量的NaCl和AgNO3混合物放入水中,发生反应:NaCl+
AgNO3=NaNO3+AgCl↓,所得溶液为NaNO3和Na2SO4的混合液,用石墨电极
电解时,实质是电解水,阳极上生成的物质是O2。
本题难度:一般
4、填空题 甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙。则下列叙述正确的是?(?)
A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲、乙中溶液的PH值逐渐升高,丙中溶液的PH值逐渐减小
参考答案:
C
本题解析:
本题考查原电池和电解池的原理。从题意可知,甲是原电池,乙和丙是电解池,A选项错误;和电源正极相连的电极是阳极,阳极上发生氧化反应,和电源负极相连的电极是阴极,阴极上发生还原反应,所以C1、C2分别是阳极、阴极,铁片作为阴极,发生还原反应,锌片作为原电池的负极,发生氧化反应,B选项错误;甲的总反应是Zn+2H+=Zn2++H2↑,pH增大,乙是电解氯化铜溶液,pH增大,丙是电解饱和食盐水,生成NaOH,pH增大,D选项错误。
本题难度:一般
5、选择题 通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银) ∶n(硝酸亚汞)=2∶1,则下列叙述正确的是
[? ]
A.在两个阴极上得到的银和汞的物质的量之比n(银) ∶n(汞)=2∶1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的化学式为HgNO3
D.硝酸亚汞的化学式为Hg2(NO3)2
参考答案:D
本题解析:
本题难度:一般