微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(1)锰元素位于第四周期,第ⅦB族.请写出Mn2+基态的电子排布式______.NO3-的空间构型为______(用文字描述).
(2)CO和N2的结构相似,CO的结构式为______.HCHO中含有的σ键和π键数目比为______.
(3)火山喷出岩浆中含有多种硫化物.冷却时ZnS比HgS先析出,原因是______.
(4)Cu3N形成的晶体结构如图所示.与同一个N3-相连的Cu+有______个.

2、选择题 下列微粒中,最外层是8个电子,并与Li+相差两个电子层的是( )
A.F-
B.Mg2+
C.S2-
D.Na+
3、简答题 [化学一选修物质结构与性质]
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是______?(填离子符号).
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是______.
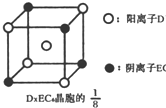
(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用

示)位于该正方体的顶点和面心,该化合物的化学式是______.
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | | Mn | Fe
|
电离
能/kj?mol-1
Ⅰ1
717
759
Ⅱ2
1509
1561
Ⅲ3
3248
2957
|
回答下列问题:
Mn元素价电子层的电子排布式为______,比较两元素的I2J3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此的解释是______;
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是______;
写出一种与CN-互为等电子体的单质分子的路易斯结构式______.
4、选择题 下列各原子或离子的电子排布式错误的是
[? ]
A.K+:1s22s22p63s23p6
B.F:1s22s22p5
C.S2-:1s22s22p63s23p4
D.Ar:1s22s22p63s23p6
5、填空题 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
(1)基态Ni原子的价电子(外围电子)排布式为______;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式______、______;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③
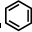
、④HCHO其中碳原子采取sp2杂化的分子有______(填物质序号),HCHO分子的立体结构为______形;
(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO______FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金的化学式为______;
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图2所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键.
