微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 还原铁粉是冶金工业的重要原料,利用绿矾制备还原铁粉的工业流程如下:
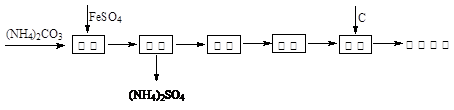
干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为 。
取干燥后的FeCO3样品12.49 g焙烧至600℃,质量变为8.00 g。所得产物用CO还原可得到Fe 6.16g。则600℃产物的可能组成是________________________________________。
根据以上数据可计算FeCO3样品中FeCO3与FeOOH的质量。FeCO3的质量为_________, FeOOH的质量为________________。
参考答案:4FeCO3·nH2O + O2 → 4FeOOH + 4CO2 +(4n-2)H2O (2分)
FeO与Fe2O3或FeO与Fe3O4或FeO、Fe2O3、Fe3O4(6分);11.6g;0.89g(各2分共4分))
本题解析:(1)FeCO3·nH2O被空气氧化为FeOOH,所以根据原子守恒可知,生成物还有CO2和水,则其化学方程式为4FeCO3·nH2O + O2 → 4FeOOH + 4CO2 +(4n-2)H2O。
(2)生成的铁的物质的量是6.16g÷56g/mol=0.11mol,则8.00g氧化物中氧原子的物质的量是(8.00g-6.16g)÷16g/mol=0.115mol,即该氧化物中氧原子和铁原子的个数之比是23:22,所以600℃产物的可能组成是FeO与Fe2O3或FeO与Fe3O4或FeO、Fe2O3、Fe3O4。
(3)设FeCO3样品中FeCO3与FeOOH的物质的量分别是x和y,则116x+89y=12.49、x+y=0.11,解得x=0.1,y=0.01,所以FeCO3的质量为11.6g,FeOOH的质量为0.89g。
考点:考查方程式的书写、物质化学式的确定以及有关计算
点评:该题是高考中的常见题型,属于中等难度试题的考查,侧重对学生解题能力的培养。试题基础性强,贴近高考,旨在培养学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确反应原理,然后结合题意灵活运用即可。
本题难度:一般
2、选择题 铅笔芯的主要成分是石墨和粘土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg。那么一个铅笔字含有的碳原子数约为
[? ]
A.2.5×1019个
B.2.5×1022个
C.5×1019个
D.5×1022个
参考答案:A
本题解析:
本题难度:简单
3、选择题 设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是(?)
A.1molCl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
参考答案:B、C
本题解析:Fe过量可使Fe3+还原为Fe2+,A错误。3NO2+H2O==2HNO3+NO,易知B正确。C中,可把N2O4看作2NO2,则有1moLNO2,所以有3mol原子;也可以用极端方法,看作全部NO2或全部N2O4考虑,也可得出结果。3Fe+4H2O===Fe3O4+4H2↑,由方程可知D错误。
本题难度:一般
4、选择题 一种可溶的金属氯化物(RClx),为了测试该金属氯化物的成分,取物质的量浓 度为0.05 mol·L-1的(RClx)
度为0.05 mol·L-1的(RClx) 溶液20mL,使之恰好与20 mL 0.15 mol·L-1AgNO3溶液完全反应,则该氯化物的化学式为(?)
溶液20mL,使之恰好与20 mL 0.15 mol·L-1AgNO3溶液完全反应,则该氯化物的化学式为(?)
A.RCl
B.RCl2
C.RCl3
D.RCl4
参考答案:C
本题解析:略
本题难度:一般
5、选择题 某氧化物的相对分子质量为a,其相同价态的硫酸盐的相对分子质量为b,则该元素的化合价的数值为:
A.(b-a)/20
B.(b-a)/40
C.(a -b)/80
D.(a-b)/20