微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)在-50℃时,液氨存在如下电离:2NH3?NH4++NH-2,k=2×10-12,液氨的电离达到平衡时,各微粒的浓度大小关系为______,加入NH4Cl固体,K______2×10-12(填“<”、“>”或“=”)
(2)已知25℃时Ksp(AgCl)=1.8×10--10,在10mL?0.10mol/L?AgNO3溶液中加入10mL0.20mol/LNaCl溶液,充分反应后溶液中的c(Ag+)=______.
(3)配平硫酸亚铁加强热制备铁红和生成硫的两种常见氧化物的化学方程式:
______FeSO4
______Fe2O3+____________+____________
(4)已知氯气能溶于水,溶液呈酸性.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是______
A.产生气体的体积:①>②
B.溶液的pH变化:①减小,②增大
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极?2Cl--2e-?Cl2↑? ②中负极?2H++2e-?H2↑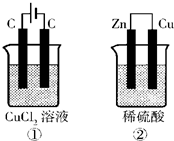
参考答案:解;(1)在液氨中,存在最多的微粒是液氨分子,由液氨电离出的铵根和亚铵根离子浓度一定是相等的,即c(NH3)>c(NH4+)=c(NH2-),
加入氯化铵固体以后,由于温度不变,所以K不变,故答案为:c(NH3)>c(NH4+)=c(NH2);=;
(2)10mL?0.10mol/L?AgNO3溶液中加入10mL0.20mol/LNaCl溶液,反应后剩余氯离子的物质的量浓度为(0.2×0.01)mol-(0.1×0.01)mol0.02L=0.05mol/L,
根据氯化银的Ksp=[Ag+][Cl-],则[Cl-]=Ksp[Ag+]=1.8×10-10mol2/L20.05mol/L=3.6×10-9mol/L,故答案为:3.6×10-9mol/L;
(3)硫的两种常见氧化物是二氧化硫和三氧化硫,根据原子守恒,则2FeSO4=Fe2O3+SO2↑+SO3↑,故答案为:2;1;1;1;
(4)A.①的原理方程式为:CuCl2?通电?.?Cu+Cl2↑,②的原理方程式为:Zn+2H+=Zn2++H2↑,当转移电子为0.02mol时,则①中产生氯气味0.01mol,
②中产生的氢气为0.01mol,产生气体的体积:①=②,故A错误;
B.①氯化铜电解实质是电解物质本身,②消耗氢离子,所以酸性溶液的pH变化:①不变,②增大,故B错误;
C.当转移电子为0.02mol时,①中阴极上析出金属铜为0.01 mol,即0.64g,②电极上析出氢气0.01mol,即0.02g,所以析出物质的质量:①>②,故C正确;
D.电极反应式:①中阳极发生失电子的氧化反应,即2Cl--2e-?Cl2↑,②中负极为金属锌,发生失电子的氧化反应,即Zn-2e-=Zn2+,故D错误.
故选C.
本题解析:
本题难度:一般
2、填空题 过量铁粉与稀硝酸反应的方程式为:
3Fe + 8HNO3 (稀)= 3Fe(NO3)?2 + 2NO↑ + 4H2O
①?标出电子转移的方向和数目
② 该反应的氧化剂是?,还原产物是?;
③ 标准状况下,当生成2.24L NO气体时, 有??g Fe参加反应,转移的电子总数为个,有?mol氧化剂被还原。
参考答案:
①?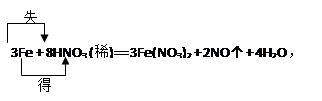 ?
?
② HNO3,NO? ③8.4,0.3NA,0.1
本题解析:反应中Fe由0价升为+2价,每3molFe反应,失6mole-。N由+5价降为+2价,每生成2molNO转移6mole-。还原剂是Fe、氧化剂是硝酸、氧化产物是硝酸亚铁、还原产物是NO。每生成1molNO,有1.5molFe反应,转移3mole-,有1molHNO3被还原。
点评:氧化还原反应中,还原剂失电子、被氧化、生成氧化产物;氧化剂得电子、被还原、生成还原产物。
本题难度:简单
3、选择题 水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2 +xOH-=Fe(FeO2)2+S4O62-+2H2O
下列说法中不正确的是
A.每生成1mol Fe(FeO2)2转移4mol电子
B.该反应中Fe2+和S2O32-都是还原剂
C.3mol Fe2+被氧化时有1molO2被还原
D.反应方程式中化学计量数x=4
参考答案:C
本题解析:A、由反应方程式知,每生成1mol Fe(FeO2)2时1molO2参加反应,转移的电子为4mol,正确;B、该反应中铁元素的化合价由+2价升高到+3价,硫元素的化合价由+2价升高到+2.5价,该反应中Fe2+和S2O32-都是还原剂,正确;C、由反应方程式知,3molFe2+参加反应时只有2mol被氧化,此时该反应中1molO2被还原,错误;D、根据电荷守恒可知, x=4,正确。
本题难度:一般
4、选择题 干燥剂的干燥性能值可用干燥效率(1?m3空气中实际残留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下

根据以上数据,下列叙述错误的是
[? ]
A.上述干燥剂中阳离子对干燥效率的影响比阴离子小
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.MgO的干燥性能比CaO好
参考答案:A
本题解析:
本题难度:一般
5、填空题 普通玻璃、钢铁和玻璃钢是三种不同的材料,它们在性能方面差别很大。请根据学过的知识,回答下面问题。
(1)普通玻璃的成分是?;
(2)铁在人类的生产和生活中有着十分重要的应用。铁的应用,经历了?到?到?的演变过程。
(3)某种复合材料具有耐高温,强度高,导电性好,导热性好的特点,估计该复合材料的基体和增强体材料可能分别是
A.金属;C
B.陶瓷;SiO2
C.合成树脂;SiO2、Al2O3、MgO
D.合成树脂;C
参考答案:(1)硅酸钙、硅酸钠、二氧化硅。(2)铁、普通钢、不锈钢。(3)A
本题解析:(1)玻璃是常见的硅酸盐材料。制普通玻璃的主要原料是纯碱、石灰石和石英。生产玻璃时,把原料粉碎后按一定比例混合后,放入玻璃熔炉中加强热,石灰石与石英反应生成硅酸钙和二氧化碳,纯碱与石英反应生成硅酸钠和二氧化碳,但原料中石英是过量的,所以普通玻璃的成分为硅酸钙、硅酸钠、二氧化硅。(2)由铁矿石炼得的生铁虽然硬度很大,但较脆且不易加工,人们就想办法降低生铁中的碳元素,调节其中的硅、锰等元素,将铁转化为钢,大大改善了其性能。但是,钢铁很容易锈蚀,于是不锈钢应运而生。因此,铁的应用经历了“铁——普通钢——不锈钢等特种钢”的演变过程。(3)复合材料兼具有基体和增强体的优点,据此可判断,应该为金属和C的复合材料。
本题难度:简单