微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金,使其转化为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液.反应的部分化学方程式如下(A为还原剂):?
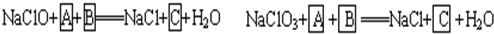
试回答下列问题:
(1)上述反应中,A为:______(写化学式,下同),C为:______.
(2)配平下列离子方程式:?
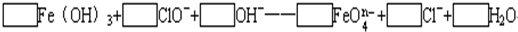
(3)已知有3.21g?Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______,FeO
中铁的化合价为______.
(4)根据(2)、(3)推测FeO能与下列哪些物质反应(只填序号)______.
A.Cl2?B.SO2C.H2S?D.O2?
参考答案:(1)根据题意知,次氯酸钠和氯酸钠都是氧化剂,A是还原剂,则A失电子化合价升高,且溶液中含有硫酸,所以A中含有硫酸根离子且具有还原性,结合实验目的把Fe2+氧化为Fe3+从而使Fe3+转化为某种沉淀析出知,A是硫酸亚铁,B是硫酸,结合元素守恒知,C是硫酸铁,
故答案为:FeSO4,Fe2(SO4)3;
(2)该反应中铁元素的化合价+3→+(8-n),失去(5-n)个电子,氯元素的化合价+1→-1价,得到2个电子,得失电子的最小公倍数是2(5-n),所以氢氧化铁的计量数是2,次氯酸根离子的计量数是5-n,然后根据原子守恒配平方程式得
2Fe(OH)3+(5-n)ClO-+2nOH-=2 FeO4n-+(5-n)Cl-+(n+3)H2O,
故答案为2、5-n、2n、2、5-n、n+3;
(3)2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(n+3)H2O转移电子
? 214g? 2(5-n)×6.02×1023?
? 3.21g?5.42×1022
?n=5-214×5.42×10223.21×2×6.02×1023=2,FeO42-中铁的化合价=-2-(-2)×4=+6,
故答案为:2,+6;?
(4)FeO42-中铁元素化合价是最高价,所以该离子具有强氧化性,能和强还原性的物质反应,氯气和氧气具有强氧化性,所以不能和高铁酸根离子反应,二氧化硫和硫化氢具有强还原性,所以能和高铁酸根离子反应,故选B、C.
本题解析:
本题难度:一般
2、选择题 在反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为( )
A.8 mol
B.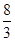 mol
mol
C.2 mol
D. mol
mol
参考答案:D
本题解析:根据方程式可知,每消耗3mol铜,生成2molNO,这说明被还原的硝酸是2mol。所以当有1 mol铜被氧化时,被还原的硝酸的物质的量是 ?mol,答案选D。
?mol,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养。该题的关键是明确氧化还原反应的有关概念,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和规范的答题能力。
本题难度:简单
3、填空题 某一反应体系中有反应物和生成物共八种物质:KMnO4、SO2、CuS、H2SO4、CuSO4、K2SO4、MnSO4、H2O。反应中氧化过程如下:CuS→SO2。
(1)该反应中被还原的元素是___________,CuS发生氧化反应的实质是__________。
(2)若反应过程中转移了3 mol电子,则参加反应的CuS的物质的量为________mol。
(3)写出并配平该反应的化学方程式 ________________________________________。
(4)当KMnO4过量时,KMnO4会继续与SO2发生如下反应:
2KMnO4+5SO2+2H2O → 2H2SO4+K2SO4+2MnSO4
该反应中氧化产物与还原产物的物质的量之比为 _______。
参考答案:(8分)
(1) ,-2价的硫失去电子变成+4价的硫(
,-2价的硫失去电子变成+4价的硫(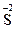 →
→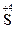 ,或者硫元素原子失去电子)。?(2)0.5 mol (本空2分)。?
,或者硫元素原子失去电子)。?(2)0.5 mol (本空2分)。?
(3)6KMnO4+5CuS+14H2SO4 → 3K2SO4+6MnSO4 +5CuSO4+5SO2↑+14H2O。
(4)5:2(或者2.5)(本空2分)。
本题解析:略
本题难度:简单
4、填空题 我国目前使用碘酸钾作为食用盐中碘强化剂。并规定,食用盐碘含量的平均水平(以碘元素计)为20 mg/kg ~ 30 mg/kg。
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式。
?KIO3+?KI+?H2SO4=?K2SO4+?I2+?H2O
反应中有1.5mol I2生成时转移电子数是?。
(2)已知:I2+2S2O32-=2 I-+S4O62-,某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取20 .0g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是??。
②根据以上实验和包装袋说明,所测精制盐的碘含量是?mg/kg。(保留一位小数)
参考答案:(1) 1?KIO3+?5?KI+?3?H2SO4=?3?K2SO4+ 3 I2+?3?H2O? 2.5NA或者1.51×1024
(2)①蓝色褪去,半分钟内不再变色?② 21.2
本题解析:(1)根据在氧化还原反应中,反应前后各元素的原子个数相等,电子转移数目相等。可的方程式为: 1?KIO3+?5?KI+?3?H2SO4=?3?K2SO4+ 3 I2+?3?H2O 。 在反应方程式中产生3molI2转移电子5mol,所以若反应中有1.5mol I2生成时转移电子数是2.5NA。(2)(2)①碘单质遇淀粉变蓝色。可根据蓝色褪去,半分钟内不再变色来确定反应恰好完全。②根据方程式可得关系式为:KIO3---3I2--6S2O32-.n(Na2S2O3)=2.0×10-3 mol/L×1.0×10-2 L=2.0×10-5 mol.∴n(KIO3-)=1/3×10-5 mol.该精制盐的碘含量(1/3×10-5 ×127×103mg)÷2.0×10-2Kg=21.2mg/kg。
本题难度:一般
5、填空题 请将5种物质:N2O、FeCl2、Fe(NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)?+?→?+?+?+H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为?。
参考答案:(1)FeCl2? HNO3? Fe(NO3)3? FeCl3? N2O;(2)1:8
本题解析:利用氧化剂的氧化性强于氧化产物的氧化性。还原剂的还原性强于还原产物的还原性。在题目提供的物质中,HNO3、Fe(NO3)3和FeCl3都有氧化性,而且氧化性HNO3>Fe(NO3)3和FeCl3;N2O、FeCl2有还原性,还原性FeCl2>N2O。因此该反应的方程式为:FeCl2 + HNO3 Fe(NO3)3 + FeCl3 +N2O+ H2O;根据质量守恒定律及电子守恒可知在反应中每个FeCl2只能失去1个电子,而每产生1个N2O,要得到电子8个,所以N2O与FeCl2的物质的量之比为1:8.
Fe(NO3)3 + FeCl3 +N2O+ H2O;根据质量守恒定律及电子守恒可知在反应中每个FeCl2只能失去1个电子,而每产生1个N2O,要得到电子8个,所以N2O与FeCl2的物质的量之比为1:8.
本题难度:一般