微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某氮的氧化物中,氮元素和氧元素的质量之比为7:20,此氧化物的化学式为
A.NO
B.NO2
C.N2O4
D.N2O5
参考答案:D
本题解析:分析:根据质量比,结合n=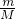 计算物质的量之比,则可确定物质的化学式.
计算物质的量之比,则可确定物质的化学式.
解答:氮元素和氧元素的质量之比为7:20,则氮元素和氧元素物质的量之比为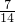 :
: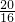 =2:5,应为N2O5,
=2:5,应为N2O5,
故选D.
点评:本题考查物质的量的计算,题目难度不大,注意相关计算公式的运用即可解答该题.
本题难度:困难
2、填空题 乙醇的结构式为: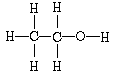 ,其在PMR 谱中有三个信号峰,其强度之比为3:2:1。分子式为C3H6O 的三种有机物,如果在PMR谱上观察氢原子给出的峰有三种情况。第一种物质峰的强度之比为3:3;第二种物质峰的强度之比为3:2:1;第三种物质峰的强度之比为2:1:2:1。由此可推断该有机物结构简式为___________、____________、____________。
,其在PMR 谱中有三个信号峰,其强度之比为3:2:1。分子式为C3H6O 的三种有机物,如果在PMR谱上观察氢原子给出的峰有三种情况。第一种物质峰的强度之比为3:3;第二种物质峰的强度之比为3:2:1;第三种物质峰的强度之比为2:1:2:1。由此可推断该有机物结构简式为___________、____________、____________。
参考答案: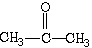 ?;CH3CH2CHO? ;CH2=CHCH2OH
?;CH3CH2CHO? ;CH2=CHCH2OH
本题解析:
本题难度:一般
3、选择题 设阿伏加德罗常数的值约为6.02×1023,则下列有关叙述正确的是
A.分子数为6.02×1023的N2、C2H4混合气体体积约为22.4?L,质量为28?g
B.100?mL?1?mol/L?的AlCl3溶液中含有6.02×1022个Al3+
C.将4?g?NaOH溶于100?mL蒸馏水,所得溶液物质的量浓度是1?mol/L
D.标准状况下,2.24?L?丙烷中含有1.204×1023个碳碳单键
参考答案:D
本题解析:分析:A、依据n= 计算物质的量,温度压强不知,气体体积不能确定;
计算物质的量,温度压强不知,气体体积不能确定;
B、铝离子水溶液中水解;
C、溶液体积大于100ml;
D、依据n=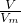 计算气体物质的量,结合丙烷分子结构计算碳碳键数;
计算气体物质的量,结合丙烷分子结构计算碳碳键数;
解答:A、分子数为6.02×1023的N2、C2H4混合气体物质的量为1mol,N2、C2H4的摩尔质量都巍峨28g/mol,质量为28g,但温度压强不知体积不能计算,故A错误;
B、铝离子水溶液中水解,100 mL 1 mol/L 的AlCl3溶液中含有Al3+小于6.02×1022个,故B错误;
C、将4 g NaOH溶于100 mL蒸馏水,溶液体积大于100ml,所得溶液物质的量浓度大于1 mol/L,故C错误;
D、标准状况下,2.24 L 丙烷物质的量为0.1mol,分子中含有0.2mol碳碳键,化学键数为1.204×1023个碳碳单键,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查微粒输的计算应用,盐类水解的分析,题目难度中等.
本题难度:困难
4、选择题 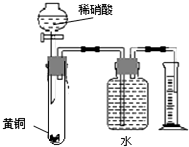 下列对有关实验的描述不正确的是
下列对有关实验的描述不正确的是
A.在浓氨水中加入生石灰可以制取少量的NH3
B.用水就可以一次性鉴别溴苯、苯、乙酸三种物质
C.用如右图所示的装置可以测定黄铜(Cu、Zn合金)中Zn的含量
D.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质可以是H2O、Ba(OH)2、Na2CO3、HCl
参考答案:C
本题解析:分析:A、生石灰可以吸收氨水中的水,让其中的氨气挥发出来;
B、溴苯和水互不相溶,且密度比水大,苯和水互不相溶,密度比水小,乙酸和水互溶;
C、Cu、Zn均能和稀硝酸反应生成对应的盐和一氧化氮,用排水量气法时,洗气瓶的导管要短进长出;
D、粗盐的提纯步骤:先溶解粗盐,再过滤,然后向滤液中加入氢氧化钡,除去粗盐中的硫酸根离子和镁离子,再过滤,向滤液中加入碳酸钠,除去粗盐中的钙离子和多余的钡离子,最后加盐酸,除去多余的碳酸根离子;
解答:A、生石灰可以吸收氨水中的水,让其中的氨气挥发出来,可以在浓氨水中加入生石灰可以制取少量的NH3,故A正确;
B、溴苯和水互不相溶,且密度比水大,混合后分层,上层是水,下层是溴苯,苯和水互不相溶,密度比水小,混合后分层,上层是苯,下层是水,乙酸和水互溶,不分层,故B正确;
C、Cu、Zn均能和稀硝酸反应生成对应的盐和一氧化氮,但是用排水量气法时,洗气瓶的导管要短进长出,故C错误;
D、粗盐的提纯步骤:先溶解粗盐,再过滤,然后向滤液中加入氢氧化钡,除去粗盐中的硫酸根离子和镁离子、铁离子等,再过滤,向滤液中加入碳酸钠,除去粗盐中的钙离子和多余的钡离子,最后加盐酸,除去多余的碳酸根离子,碳酸钠必须加在氢氧化钡的后面,最后加盐酸,故D正确;
故选C.
点评:本题考查学生对有关化学实验基本知识的掌握程度,要求学生熟记所学知识,学以致用.
本题难度:困难
5、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,22.4L氧气所含的原子数为2NA
B.18g水所含的电子数为NA
C.8g?He所含的分子数为NA
D.16g?O2与16g?O3所含的原子数均是NA
参考答案:D
本题解析:分析:A.气体体积与温度和压强有关;
B.根据n= 计算?H2O的物质的量,1个水分子中含有10个电子;
计算?H2O的物质的量,1个水分子中含有10个电子;
C.根据n= 计算?He的物质的量;
计算?He的物质的量;
D.根据n= 计算?16g?O2与16g?O3的物质的量;
计算?16g?O2与16g?O3的物质的量;
解答:A.标准状况下,22.4L?氧气的物质的量为1mol,分子数为NA.常温常压下,温度升高,体积膨胀,故22.4L氧气的物质的量小于1mol,气体的分子数小于NA,故A错误;
B.H2O的物质的量为n= =
= =1mol,1个水分子中含有10个电子,1molH2O所含的电子数为10NA,故B错误;
=1mol,1个水分子中含有10个电子,1molH2O所含的电子数为10NA,故B错误;
C.He的物质的量为n= =
=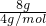 =2mol,所含的分子数为2NA,故C错误;
=2mol,所含的分子数为2NA,故C错误;
D.16g?O2的物质的量为n= =
=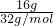 =0.5mol,1个氧气分子中含有2个氧原子,16g?O2所含的原子数为0.5mol×2=1mol,16g?O3的物质的量为n=
=0.5mol,1个氧气分子中含有2个氧原子,16g?O2所含的原子数为0.5mol×2=1mol,16g?O3的物质的量为n= =
=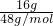 =
= mol,1个臭氧气分子中含有3个氧原子,16g?O3的所含的原子数为
mol,1个臭氧气分子中含有3个氧原子,16g?O3的所含的原子数为 mol×3=1mol,则二者的原子得物质的量相同、原子数相同均是NA,故D正确;
mol×3=1mol,则二者的原子得物质的量相同、原子数相同均是NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的有关问题,注意物质与微粒的关系,注意单位的运用,题目较简单.
本题难度:一般