微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²
参考答案:
本题解析:
本题难度:困难
2、填空题 如下图所示装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。
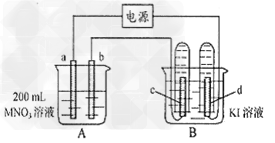
试回答:
(1)a为___________极
(2)电解开始时,在B烧杯的中央滴几滴淀粉溶液,你能观察到的现象是__________电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为:_____________。
(3)当d电极上收集到44.8?ml气体(标准状况)时停止电解,a极上放出了__________ml气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为_________g·moL-1。
参考答案:(1)阳
(2)在C处变蓝?;?4OH--4e-=2H2O+O2↑
(3)22.4 ;108
本题解析:
本题难度:一般
3、填空题 日常饮用水中NO3一的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:

请回答下列问题:
(1)该方案在调节pH时,若pH过大或过小都会造成 的利用率降低。
(2)已知过滤后得到的滤液中几乎不含铝元素。①在溶液中铝粉和NO3一反应的离子方程式为 。
②滤渣在空气中煅烧过程中涉及的相关反应方程式为
(3)用H2催化还原法也可降低饮用水中NO3—的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 。
(4)饮用水中的NO3- 主要来自于NH4+。已知在微生物作用下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:
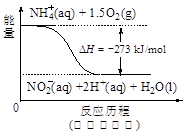
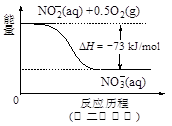
试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。
(5)固体a熔融电解时阴极反应式为
参考答案:(1)铝(或Al)(2分)
(2)①10Al+6NO3—+18H2O=10Al(OH)3↓+3N2↑+6OH—(2分)
②4Al+ 3O2 2 Al2 O3 2Al(OH)3
2 Al2 O3 2Al(OH)3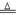 Al2 O3+3 H2O(各2分)
Al2 O3+3 H2O(各2分)
(3)5H2+2NO3—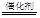 N2↑+4H2O+2OH— (2分)
N2↑+4H2O+2OH— (2分)
(或5H2+2NO3—+2H+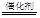 N2↑+6H2O)
N2↑+6H2O)
(4)NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l) △H=-346 kJ·mol-1(2分)
(5)Al3++3e-= Al(2分)
本题解析:(1)由于铝能和酸或碱都能反应,该方案在调节pH时,若pH过大或过小都会造成铝(或Al) 的利用率降低。(2)①铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3
本题难度:困难
4、选择题 下列有关说法正确的是
A.将0.2mol/L的NH3·H2O与0.1mol/L的HCl溶液等体积混合后pH >7,则c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有C(Mg2+)=C(CO32-),且c(Mg2+)·c(CO32-)==6.82×10-6 mol?L—1
C.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合: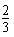 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1