微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 CsICl2是一种碱金属的化合物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是
(? )
A.Cs显+3价,I、Cl均显-1价
B.Cs显+1价,Cl显+1价,I显-1价
C.在CsICl2溶液中通入Cl2,有单质碘生成
D.在CsICl2溶液中通入SO2气体,有硫酸生成
参考答案:D
本题解析:Cs为第ⅠA族元素,在化合物中只显+1价,I、Cl相比,Cl的非金属性强,所以Cs显+1价,I显+1价,Cl显-1价,A、B错;+1价的碘不可能氧化Cl2而使自己被还原为单质碘,因为氯水的氧化性比+1价的碘强,C错;D对。
本题难度:一般
2、选择题 某物质的焰色反应呈黄色,下列判断正确的是(?)
A.该物质一定是金属钠
B.该物质一定是钠盐
C.该物质一定含有钠元素
D.该物质一定不含有钾元素
参考答案:C
本题解析:某些金属及其化合物在灼烧时产生不同颜色的火焰,称为焰色反应,该物质焰色反应为黄色,表明含钠元素。
本题难度:一般
3、填空题 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
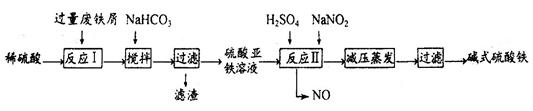
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
|
?
回答下列问题:
(1)反应I溶液中存在的金属阳离子有__________________。
(2)加入NaHCO3的目的是调节pH,使溶液中的______(填“Fe3+”、“Fe2+”或“A13+”)沉淀。该工艺流程中“搅拌”的作用是_____________。
(3)反应II的离子方程式为__________。在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为________。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为__________。
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为__________________________。
参考答案:(1)Fe2+、Al3+(1分,有错不得分)
(2)Al3+(1分);加快反应速率(或使反应物充分接触,意思相近均给分)(1分)
(3)Fe2++NO2-+2H+=Fe3++NO↑+H2O(2分);氧化剂(1分);2mol(1分)
(4)2[Fe(OH)]2++2H2O [Fe2(OH)4]2++2H+(2分)
[Fe2(OH)4]2++2H+(2分)
本题解析:(1)稀硫酸与铁、氧化铝、氧化铁反应的生成物分别是硫酸亚铁和氢气、硫酸铝和水、硫酸铁和水。由于铁是过量的,所以生成的硫酸铁继续与铁反应生成硫酸亚铁,因此反应I溶液中存在的金属阳离子有Fe2+、Al3+。
(2)由于溶液中只有Fe2+、Al3+两种金属阳离子,而氢氧化铝开始沉淀时的pH值大于氢氧化亚铁开始沉淀时的pH值,所以加入NaHCO3的目的是调节pH,使溶液中的Al3+沉淀;由于搅拌时可以增大反应物的接触面积,从而加快反应速率。
(3)反应II中有NO生成,这说明反应中亚硝酸是氧化剂,将亚铁离子氧化生成了铁离子,反应的离子方程式为Fe2++NO2-+2H+=Fe3++NO↑+H2O;由于要将亚铁离子氧化为铁离子,所以O2与NaNO2在反应中均作为氧化剂;标准状况下11.2L氧气的物质的量是11.2L÷22.4L/mol=0.5mol,氧气在反应中得到4个电子,所以0.5mol氧气可以得到2mol电子。亚硝酸钠中氮元素的化合价是+3价,其还原产物中氮元素的化合价是+2价,得到1个电子,所以根据电子守恒可知,相当于是节省了2mol亚硝酸钠。
(4)[Fe(OH)]2+离子可部分水解生成[Fe2(OH)4]2+聚合离子,则根据电荷守恒可知一定还有氢离子生成,所以反应的离子方程式为2[Fe(OH)]2++2H2O [Fe2(OH)4]2++2H+。
[Fe2(OH)4]2++2H+。
本题难度:一般
4、选择题 将一定量Fe和Fe2O3混合物放入2 mol·L-1的HNO3溶液25mL中,反应完成后,无固体剩余,生成224mLNO气体(标准状况),再向反应后的溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
A.45mL
B.50mL
C.40mL
D.无法确定
参考答案:C
本题解析:根据题意知,HNO3的物质的量为0.025L×2mol·L-1=0.05mol,生成NO的物质的量为0.01mol,所以与一定量Fe和Fe2O3的混合物反应后溶液中含有的NO3-的物质的量为0.05mol-0.01mol=0.04mol,再向反应后的溶液中加入1mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所得溶液的溶质为NaNO3,所以需要NaOH的物质的量为:n(NaOH)=n(NO3-)=0.04mol,则所加NaOH溶液的体积最少是0.04L,即40ml,选C。
本题难度:一般
5、选择题 下列金属用途与性质不相对应的是(?)
A.用铜作电线是由于其导电性良好
B.用钨作灯丝是因为其熔点高
C.铁制品表面镀铬是由于铬硬且不易被氧化
D.用铝制作炊具是因为铝的熔点比铁高
参考答案:D
本题解析:铜是硬度较小的紫红色金属,有良好的延展性、导电性和导热性,可用铜做电线。钨是熔点最高的金属,做灯丝。铬是较硬的金属,铁制品表面镀铬是由于铬硬且不易被氧化。只有D不正确。
本题难度:一般