微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 锌(Zinc)是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池制造有不可磨灭的贡献。
Ⅰ.湿法炼锌
某种冶炼过程可用下图简略表示

(1)ZnS焙烧反应的化学方程式为_____________________________________。
(2)电解过程中析锌一极的电极反应式为_______________________________。
(3)氧化锌像氧化铝一样,属于两性氧化物,则氧化锌与氢氧化钠反应的离子方程式为_________________________________________________________。
(已知:“锌酸”的化学式可写成H2[Zn(OH)4])
Ⅱ.锌电池
用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等。
(4)锌锰碱性电池,以二氧化锰为正极,锌粒为负极,氢氧化钾溶液为电解液。其具有容量大、放电电流大的特点,因而得到广泛应用。电池总反应式为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。
碱性电池中,负极锌由片状改变成粒状的优点是_______________________;正极反应式为________________________________________________________________________。
(5)新型锌空电池(如图)与锂电池相比,锌空气充电电池的储存电量是它的三倍,成本是锂电池的一半,并且完全没有过热爆炸的安全隐患。该电池的总反应为2Zn+O2=2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为__________________________。若以该电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有10.8 g银析出,至少需要________L空气(折算成标准状况)进入该电池。

参考答案:(1)2ZnS+3O2 2SO2+2ZnO
2SO2+2ZnO
(2)[Zn(NH3)4]2++2e-=Zn+4NH3↑
(3)ZnO+2OH-+H2O=[Zn(OH)4]2-
(4)增大了负极的反应面积,提高了放电效率 2MnO2+2H2O+2e-=2MnO(OH)+2OH-
(5)Zn-2e-+2OH-=ZnO+H2O 2.8(2.7也可)
本题解析:(2)析锌一极应是[Zn(NH3)4]2+得到电子,还原为锌,同时释放出氨气。(4)碱性锌锰电池中,负极锌失电子生成锌离子,再与溶液中的氢氧根结合生成氢氧化锌,负极反应:Zn+2OH--2e-=Zn(OH)2,正极反应:2MnO2+2H2O+2e-=2MnO(OH)+2OH-。(5)锌空电池的负极反应式为2Zn-4e-+4OH-=2ZnO+2H2O,正极反应式为O2+4 e-+2H2O=4OH-,用惰性电极电解硝酸银溶液的阴极反应式为Ag++e-=Ag,则有O2~4e-~4Ag,V(空气)=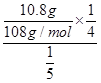 ×22.4 L·mol-1=2.8 L。
×22.4 L·mol-1=2.8 L。
本题难度:一般
2、选择题 A和B两元素分别得到两个电子后,都变成零族元素的电子层结构,其中A放出的能量比B大,因此
A.A比B容易被还原
B.A2-的还原性比B2-的强
C.A的氧化性比B弱
D.A2-比B2-的半径大
参考答案:A
本题解析:略
本题难度:简单
3、填空题 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
元素
| 有?关?信?息
|
A
| 元素主要化合价为-2,原子半径为0.074 nm
|
B
| 所在主族序数与所在周期序数之差为4
|
C
| 原子半径为0.102 nm,其单质为黄色晶体,可在A的单质中燃烧
|
D
| 最高价氧化物的水化物能按1︰1电离出电子数相等的阴、阳离子
|
E
| 原子半径为0.075 nm,最高价氧化物的水化物可与其氢化物形成一种盐X
|
?
(1)写出C元素在周期表中的位置 ?,写出D元素最高价氧化物的水化物电子式 ?;
(2)写出B单质与水反应的离子方程式?;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式?;
(4)X的水溶液显 (填“酸”、“碱”或“中”)性,用离子方程式解释其原因是 ?;
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为?;
(6)若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,燃料电池中转移的电子数为?NA。
参考答案:(1)第三周期 VIA族;?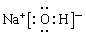 ;
;
(2)Cl2 + H2O Cl-+ H+ + HClO?;
Cl-+ H+ + HClO?;
(3)2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2?;
(4)酸; ?NH4++ H2O NH3·H2O + H+?;
NH3·H2O + H+?;
(5)O2+2H2O+4e- ="=" 4OH-?;
(6)2.5?。
本题解析:根据题意可知这几种元素分别是A是O;B是Cl;C是S;D是Na;E是N。X是NH4NO3。(1)S元素在周期表中位于第三周期 VIA族。Na元素最高价氧化物的水化物NaOH的电子式为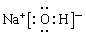 。(2)Cl2与水反应的两种方程式为:Cl2+H2O
。(2)Cl2与水反应的两种方程式为:Cl2+H2O H++Cl-+HClO。(3)元素O和Na形成的化合物Na2O2可作为呼吸面具中氧气的来源,该反应的化学方程式为2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2。(4)X NH4NO3是强酸弱碱盐,在溶液中存在水解平衡:NH4++ H2O
H++Cl-+HClO。(3)元素O和Na形成的化合物Na2O2可作为呼吸面具中氧气的来源,该反应的化学方程式为2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2。(4)X NH4NO3是强酸弱碱盐,在溶液中存在水解平衡:NH4++ H2O NH3·H2O + H+,消耗了水电离产生的OH-,使OH-的浓度减小,促进了水的电离,当最终达到电离平衡时,由于溶液中c(OH-)<c(H+).所以其水溶液显酸性。(5)O2的相对分子质量为32,与其等式量的N的氢化物的化学式为N2H4,俗称联氨。燃料N2H4与空气组成的燃料电池中,燃料N2H4为负极,空气的电极为正极。电解质溶液是30%的KOH溶液,则该电池放电时的正极电极反应式为O2+2H2O+4e- ="=" 4OH- 。(6)在整个闭合回路中电子转移的物质的量相等。若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,n(Cu)=80g÷64g/mol=1.25mol,所以n(e-)=2.5mol.即燃料电池中转移的电子数N=2.5NA。
NH3·H2O + H+,消耗了水电离产生的OH-,使OH-的浓度减小,促进了水的电离,当最终达到电离平衡时,由于溶液中c(OH-)<c(H+).所以其水溶液显酸性。(5)O2的相对分子质量为32,与其等式量的N的氢化物的化学式为N2H4,俗称联氨。燃料N2H4与空气组成的燃料电池中,燃料N2H4为负极,空气的电极为正极。电解质溶液是30%的KOH溶液,则该电池放电时的正极电极反应式为O2+2H2O+4e- ="=" 4OH- 。(6)在整个闭合回路中电子转移的物质的量相等。若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,n(Cu)=80g÷64g/mol=1.25mol,所以n(e-)=2.5mol.即燃料电池中转移的电子数N=2.5NA。
本题难度:一般
4、填空题 (12分
下图是元素周期表的一部分:

⑴表中区域名称s、p……等确定的依据是_______________________________________。
⑵已知A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A的核外电子排布式为______________,B在元素周期表中的位置是___________。
⑶上表中元素x的一种氢化物的晶体结构如图所示,写出该化合物在氯气中燃烧的化学方程式?。
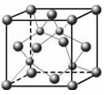
除x外,第四周期中最外层只有一个电子的还有?(填元素名称)。
⑷表中短周期非金属元素之间可以形成形形色色的有机物,如邻羟基苯甲醛(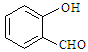 )和对羟基苯甲醛(
)和对羟基苯甲醛(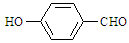 ),前者沸点低于后者,理由是
),前者沸点低于后者,理由是
? _____?。
参考答案:(12分)
⑴根据构造原理最后填入电子的能级的符号(2分)

本题解析:
(1)根据构造原理最后填入电子的能级的符号。
(2)列表分析? K? L? M? N
A? 2? 8? 11? 2
B? 2? 8? 18? 6
A的电子排布式为:1s22s22p63s23p63d34s2,B为第四周期ⅣA族锗;
(3)由图可知:晶胞中Cu?原子个数为8×1/8+6×1/2=4,H原子个数为4,所以化学式为CuH,,在Cl2中燃烧的方程式为:2CuCl+3Cl2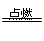 2CuCl2+2HCl;
2CuCl2+2HCl;
除Cu外,第四周期中最外层只有一个电子的还有钾与铬,[Ar]4s1? [Ar]3d54s1
(4)邻羟基苯甲醛存在分子内氢键,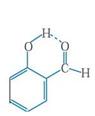 而对羟基苯甲醛存在分子间氢键
而对羟基苯甲醛存在分子间氢键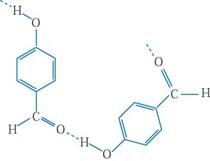
本题难度:一般
5、选择题 A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中正确的是
A.原子序数: B>A>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
参考答案:C
本题解析:
A , B , C ,分别为三种短周期元素,B2+和C-具有相同的电子层结构,说明B为第三周期元素、C为第二周期元素或B为第二周期元素、C为第一周期元素;
当B为第三周期元素、C为第二周期元素时,B2+表示失去2个电子、C-表示得到1个电子,B为镁、C为氟,由于A , B ,在同一周期,A 的最低价阴离子分别为A2-,A2-表示得到2个电子达到8个电子稳定结构,则A为硫元素。
A、原子序数A>B>C,所以A错误;
B原子半径:B>A>C,所以B错误;
C离子半径:A2->C->B2+,正确;
D 原子核外最外层电子数:C>A>B,所以D错误。
同理当B为第二周期元素、C为第一周期元素时,A为氧、B为铍、C为氢。
A、原子序数A>B>C,所以A错误;
B原子半径:B>A>C,所以B错误;
C离子半径:A2->C->B2+,正确;
D 原子核外最外层电子数:A>B>C,所以D错误。
综上所分析可知,只有C正确。
本题难度:一般