| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《水的电离平衡》高频试题强化练习(2017年最新版)(八)
参考答案:B 本题解析:A.在任何物质的稀溶液中都含H+的溶液,所以,含有H+的溶液不一定显酸性。错误。B.在任何物质的稀溶液中都存在水的电离平衡:H2O 本题难度:一般 3、选择题 下列叙述正确的是 |
参考答案:AD
本题解析:根据盐的组成可知,溶质浓度相同时,硫酸铵溶液中的铵根离子浓度比氯化铵溶液中的大,而硫酸亚铁铵溶液中的铵根离子浓度比硫酸铵中小,因为亚铁离子的水解反应能抑制铵根离子的水解,则c(NH4+):(NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl,反之,若三种铵盐溶液中c(NH4+)相等,硫酸亚铁铵浓度保持不变时,则氯化铵浓度增大的程度最大,硫酸铵浓度增大的程度其次,所以溶质浓度大小关系为c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl),故A选项正确;由于n=c?V,则HY和NaOH的物质的量相等,二者恰好完全中和,生成NaY溶液,由于溶液pH=9,即溶液显碱性,说明NaY是强碱弱酸盐、HY是弱酸,相同,由于c(H+)=10—pHmol/L=10—9mol/L,Kw=c(H+)?c(OH-)=10—14,则该碱性溶液中的溶液中c(OH-)=Kw/c(H+)=10—5mol/L,由于NaY溶液中质子守恒关系式为c(OH-)=c(H+)+c(HY)= 10—5mol/L,故B选项错误;强酸与强碱混合时强酸过量,则混合后溶液中c(H+)=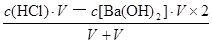 =
=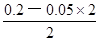 mol/L=0.05mol/L,由于pH="—lg" c(H+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO3=Na++HCO3—、H2O
mol/L=0.05mol/L,由于pH="—lg" c(H+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO3=Na++HCO3—、H2O H++OH—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO3—+ H2O
H++OH—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO3—+ H2O H2CO3+OH—、HCO3—
H2CO3+OH—、HCO3— H++ CO32—,前者消耗水电离出的氢离子浓度与生成的碳酸浓度相等,后者消耗水电离出的氢氧根离子浓度与生成的碳酸根离子浓度相等,根据质子守恒原理可得:c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D选项正确。
H++ CO32—,前者消耗水电离出的氢离子浓度与生成的碳酸浓度相等,后者消耗水电离出的氢氧根离子浓度与生成的碳酸根离子浓度相等,根据质子守恒原理可得:c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D选项正确。
考点:考查水溶液中粒子浓度大小关系,涉及盐类水解程度大小关系、盐溶液中质子守恒关系式、溶液的pH、水的离子积等。
本题难度:一般
4、实验题 (9分)某学生用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂。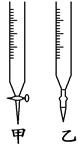
请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
(2)用标准盐酸溶液滴定时,应将标准盐酸溶液注入________(填“甲”或“乙”)中。
(3)用标准的盐酸滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手轻轻摇动锥形瓶,眼睛注视_______________________________________________________。
(4)直到因加入一滴盐酸后,溶液颜色由________色变为________色,并在30 s内不变,即为终点。
(5)下列操作中可能使所测氢氧化钠溶液浓度偏大的是________。
A.酸式滴定管未用标准盐酸润洗,直接装入标准盐酸。
B.酸式滴定管滴定前有气泡,滴定后气泡消失。
C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥。
D.读取盐酸体积开始时仰视读数,滴定结束后俯视读数。
参考答案:(9分)(1)用标准盐酸溶液润洗(2分) ;(2) 甲(1分);
(3)锥形瓶中溶液的颜色变化(2分)
(4)由黄(1分)色变为橙色(1分) ;(4)AB(2分)。
本题解析:(1)酸式滴定管用蒸馏水洗净后,为了洗去蒸馏水,应用标准盐酸溶液润洗2-3次;(2)用标准盐酸溶液滴定时,应将标准盐酸溶液注入酸式滴定管中;(3)滴定时,眼睛注视锥形瓶中溶液的颜色变化,当溶液由黄色变为橙色达到滴定终点;(4)甲基橙在碱性条件下呈黄色,在酸性条件下呈红色,中性色为橙色,变色范围pH为3.1-4.4;(5)A、酸式滴定管未用标准盐酸润洗,直接装入标准盐酸,标准盐酸被稀释,所用体积偏大,所测氢氧化钠浓度偏高;B、酸式滴定管滴定前有气泡,滴定后气泡消失,所读标准酸溶液的体积偏大,所测结果偏高;C、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥,不影响滴定结果;D、读取盐酸体积开始时仰视读数,滴定结束后俯视读数,所读标准盐酸体积偏小,测定结果偏低;答案选AB。
考点:酸碱中和滴定
本题难度:一般
5、选择题 已知NaHSO4在水中的电离方程式为:NaHSO4==Na++H++SO42-某温度下,向pH=6的蒸馏水中加入
NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列叙述中,不正确的是
[? ]
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-12mol·L-1
C.加入NaHSO4晶体抑制了水的电离
D.该温度下加入等体积pH为10的NaOH溶液可使该溶液恰好呈中性
参考答案:B
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《苯酚的性质.. | |