微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度时于密封容器中发生反应:mA(g)+nB(g) pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的是
pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍,则下列叙述正确的是
[? ]
A.平衡向正反应方向移动
B.C气体的质量分数增大
C.气体A的转化率降低
D.m+n>p
参考答案:C
本题解析:
本题难度:一般
2、选择题 COCl2(g)?

CO(g)+Cl2(g)-Q,当反应达到平衡时,分别采取下列措施,能使平衡向正反应方向移动的是( )
A.恒容通入氮气
B.恒压通入氮气
C.加催化剂
D.增加CO的浓度
参考答案:A、因恒容通入氮气,反应体系中各物质的浓度不变,则平衡不移动,故A错误;
B、因恒压通入氮气,体积变大,对于参加反应的气体物质相当于减压,化学平衡向气体体积增大的方向移动,即平衡向正反应方向移动,故B正确;
C、催化剂对化学平衡移动无影响,故C错误;
D、因CO是生成物,则增加CO的浓度化学平衡逆向移动,故D错误;
故选B.
本题解析:
本题难度:简单
3、填空题 在溶液中进行某化学反应2A B+D 在四种不同条件下进行,B、D 起始浓度为零,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如下表
B+D 在四种不同条件下进行,B、D 起始浓度为零,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如下表

根据上述数据,完成下列填空
(1)在实验1,反应在10至20分钟时间内平均速率(vA)为_________mol/(L·min)。
(2)在实验2,A的初始浓度C2=_________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_______________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填“ > ”、“ = ”、“ < ”),且C3_________1.0mol/L(填“ > ”、“ = ”、“ < ”)
(4)比较实验4和实验1,可推测该反应是_________反应(选填吸热、放热)。理由是____________________________________
参考答案:(1)0.013
(2)1.0;使用催化剂
(3)> ;>
(4)吸热;温度升高时,平衡向右移动
本题解析:
本题难度:一般
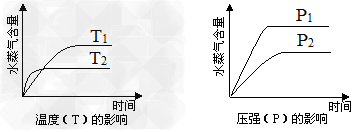
4、选择题 一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是?
[? ]
A.CO2(g)?+?H2(g) CO(g)?+?H2O(g)?ΔH>0
CO(g)?+?H2O(g)?ΔH>0
B.CH3CH2OH(g) CH2=CH2(g)?+?H2O(g)?ΔH>0
CH2=CH2(g)?+?H2O(g)?ΔH>0
C.2C6H5CH2CH3(g)?+?O2(g) 2C6H5CH=CH2(g)?+?2H2O(g)?ΔH<0
2C6H5CH=CH2(g)?+?2H2O(g)?ΔH<0
D.CO2(g)?+?2NH3(g) CO(NH2)2(s)?+?H2O(g)?ΔH<0
CO(NH2)2(s)?+?H2O(g)?ΔH<0
参考答案:D
本题解析:
本题难度:一般
5、选择题 新型陶瓷材料氮化硅(Si3N4)可以通过以下反应制得:3Si02+6C+2N2?Si3N4+6C0,下列就该反应的分析错误的是( )
A.压强增大,平衡向逆反应方向移动
B.Si02是氧化剂,CO是氧化产物
C.上述反应若为放热反应,升高温度,平衡常数将减小
D.上述反应中每生成1mol Si3N4,氮元素得12mol电子
参考答案:A.正反应是气体体积增大的反应,增大压强,平衡向逆反应方向移动,故A正确;
B.反应中N元素的化合价降低,氮气是氧化剂,C元素化合价升高,CO是氧化产物,而二氧化硅中含有元素的化合价不变,既不用氧化剂也不是还原剂,故B错误;
C.若为放热反应,升高温度,平衡向逆反应方向移动,平衡常数将减小,故C正确;
D.反应中只有N元素的化合价由0价降低为-3价,故生成1mol Si3N4,氮元素获得电子物质的量=1mol×4×3=12mol,故D正确,
故选B.
本题解析:
本题难度:简单