微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.反应热就是反应中放出的热量
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”
参考答案:C
本题解析:反应热是指在一定条件下,化学反应过程中放出或吸热的能量,也称为反应的焓变,因此选项A不正确;放热时△H<0,吸热时△H>0,所以选项B不正确;反应热还等于反应过程中断键吸收的能量和形成化学键所放出的能量的差值,所以选项D是错误的,因此正确的答案选C。
本题难度:简单
2、选择题 下列叙述正确的是(?)
A.生成物总能量一定低于反应物总能量
B.分解反应一定是吸热反应
C.应用盖斯定律,可计算某些难以直接测量的反应的焓变
D.同温同压下,H2(g)+Cl2(g)
参考答案:C
本题解析:A 错误,如果是放热反应,生成物总能量一定低于反应物总能量
B 错误,有的分解反应是放热反应。
C 正确,设计途径,可计算某些难以直接测量的反应的焓变
D 错误,H2(g)+Cl2(g)?2HCl(g)的起态和终态相同,△H就相同,与反应条件无关。
本题难度:一般
3、简答题 (16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是?
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
离子
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/ mol/L
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中的数据判断该试样的酸碱性为?,其pH=?。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式?。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)  2NO(g) △H=+180.5kJ·mol-1?
2NO(g) △H=+180.5kJ·mol-1?
ⅱ? 2C(s)+ O2(g) 2CO(g)?△H ="-" 221.0 kJ·mol-1
2CO(g)?△H ="-" 221.0 kJ·mol-1
ⅲ?C(s)+ O2(g) CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数?。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式?。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
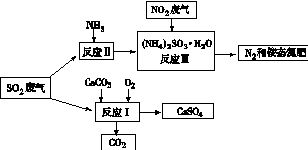
①写出反应Ⅰ的化学方程式:?。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是?。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是?。
参考答案:(16分)
(1)b、c?(2分)
(2)酸性? 4?(各1分,共2分)
(3) ①? 3NO2 + H2O = 2HNO3 + NO?(2分)
②减小?(2分)
2NO (g)+2 CO (g) =N2(g)+2CO2(g)?△H ="-" 746.5kJ/mol?(2分)
(4)①?2CaCO3 +O2 +2SO2= 2CaSO4 + 2CO2 ?(2分)
②防止亚硫酸铵(NH4) 2 SO3被氧化?(2分)
③盐酸和氯化钡(HCl 和 BaCl2)?(2分)
本题解析:(1)a、PM2.5是指微粒直径≤2.5×10-6米的微粒,而胶粒直径为1~100nm,即在10-9~10-7米之间,故在空气中不只形成了胶体,还有浊液,故a错误;b.PM2.5直径小,表面积大,能吸附大量有毒、有害物质,故b正确;c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染,故c正确,答案选bc;
(2)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性.试样的pH值根据溶液中电荷守恒得c(K+)+c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-)计算c(H+)= 10-4mol/L,pH值为4;
(3)①NO2转化为HNO3的化学方程式为:3NO2+H2O=2HNO3+NO;
②ⅰN2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1?①
ⅱ2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1?②
ⅲC(s)+O2(g)═CO2(?g)△H=-393.5kJ?mol-1?③
反应ⅲ正反应放热,温度升高平衡逆向移动,反应物浓度增大,生成物浓度减小,化学平衡常数减小;
由盖斯定律,NO(g)和CO(g)反应生成N2(g)、CO2(g)的热化学方程式可由③×2-①-②得到,即2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol;
(4)①根据反应物和生成物,写出反应Ⅰ的化学方程式为:2CaCO3+O2+2SO2=2CaSO4+2CO2;
②亚硫酸根离子易被空气中的氧气氧化,所以向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵(NH4)2SO3被氧化;
③检验SO42-所用试剂是盐酸和氯化钡(HCl和BaCl2)。
本题难度:一般
4、填空题 在一只小烧杯里,加入20 g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10 g NH4+Cl晶体,并用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是?(该空2分)
(2)写出有关反应的化学方程式:?(该空2分,余下各空1分)
该反应属?反应(填基本反应类型)。
(3)实验中观察到的现象有??、 ?且反应混合物成糊状,反应混合物呈糊状的原因是??。
(4)通过?现象,说明该反应为?热反应,这是由于反应物的总能量?生成物的总能量。
参考答案:(1)搅拌使混合物充分接触并发生反应
(2)Ba(OH)2·8 H2O+2NH4Cl=BaCl2+2NH3↑+10H2O?复分解
(3)玻璃片上结冰而与小烧杯黏结在一起?有刺激性气味?反应发生时有水生成
(4)结冰?吸?小于
本题解析:(1)实验中玻璃棒的作用是使混合物充分接触并发生反应;
(2)该反应的化学方程式为(OH)2·8 H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,是复分解反应;
(3)实验中可看到玻璃片上结冰而与小烧杯黏结在一起,有刺激性气味,因为该反应中水生成,使反应混合物成糊状;
(4)通过结冰现象,说明该反应是吸热反应,根据吸热反应中物质的能量变化关系判断这是由于反应物的总能量小于生成物的总能量。
本题难度:一般
5、选择题 在下列反应中,盐酸作氧化剂的是(?)
A.NaOH+HCl====NaCl+H2O
B.CaCO3+2HCl====CaCl2+CO2↑+H2O
C.Zn+2HCl====ZnCl2+H2↑
D.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
参考答案:C
本题解析:氧化剂在化学反应中有的元素化合价降低,A、B为复分解反应,D中HCl作还原剂。
本题难度:一般