| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《物质的量》高频试题巩固(2017年最新版)(八)
参考答案:D 本题解析:A.必须是气体分子在标准状况下,6.02×1023个所占的体积才约是22.4L,A错误;B.没有标准状况,无法计算体积,B错误;C.标准状况下,H2O是液体,无法计算体积,C错误;D正确,氧气和臭氧都是氧元素组成的单质,所以可以看成O的纯净物。 O的物质的量是n=m/M=32/16=2mol,即2NA个氧原子,D正确;选D。 本题难度:一般 2、选择题 下列叙述正确的是( ) |
参考答案:D
本题解析:略
本题难度:一般
3、填空题 将40克氢氧化钠溶于水,配成250ml溶液A,A的浓度为______mol/L.将50mlA加水稀释至100ml后,得溶液B,B的浓度为______?mol/L.将10mlB溶液与质量分数为9%、密度为1.11g/cm3?的NaOH溶液10ml混合,该混合溶液C的浓度为______mol/L.(忽略溶液体积的变化)这些混合溶液C能与______ml0.5mol/L的盐酸恰好完全中和.
参考答案:n(NaOH)=40g40g/mol=1mol,则c(A)=1mol0.25L=4mol/L;
溶液稀释前后溶质的物质的量不变,则c(B)=0.05L×4mol/L0.1L=2moL/L;
质量分数为9%、密度为1.11g/cm3的NaOH溶液的物质的量浓度为c=1000×1.11g/L×9%40g/mol≈2.5mol/L,
混合溶液C的浓度c(C)=2mol/L×0.01L+2.5mol/L×0.01L0.02L=2.25mol/L;
C中n(NaOH)=2.25mol/L×0.02L=0.045mol,则可与0.045molHCl完全中和,
所以v(盐酸)=0.045mol0.5mol/L=0.09L=90mL,
故答案为:4;2;2.25;90.
本题解析:
本题难度:一般
4、选择题 下列的各种说法中,正确的是
A.12C的相对原子质量为12g·mol-1
B.MgCl2的摩尔质量是95 g
C.0.5 mol氢元素约含6.02×1023个氢原子
D.NA常数约为6.02×1023 mol-1
参考答案:D
本题解析:A.12C的相对原子质量为12,错误; B.MgCl2的摩尔质量是95 g/mol,错误;C.0.5 mol氢元素表示的可能是H原子,也可能是H2分子,因此不能确定原子个数,错误。D.NA是1mol的物质中含有的组成该物质的基本微粒数值,是定值,近似为6.02×1023 mol-1,正确。
考点:考查阿伏伽德罗常数、相对分子质量、摩尔质量等概念、关系、单位等知识。
本题难度:一般
5、填空题 在配制一定量的物质的量浓度溶液时,下列操作使得到的溶液浓度偏高、偏低还是不变?
(1)用量筒取液态溶质,读数时俯视量筒,所配溶液浓度____________。
(2)将取样品的药匙用水洗涤,洗涤液倒入容量瓶,所配溶液浓度____________。
(3)定容摇匀后,有少量溶液外流,所配溶液浓度____________。
参考答案:(1)偏低?(2)偏高?(3)不变(或无?影响)
本题解析:(1)正确的读数方法应是视线与量筒刻度线保持水平,俯视的结果使得量取液体体积小于计算值,所以配制出的溶液浓度偏低。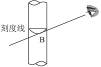
(2)药匙上的药品并未称量,洗涤后转入容量瓶,使得溶质的量增大,所配制的溶液浓度偏高。
(3)定容摇匀后,溶液的配制已经结束,从中任意取出部分,浓度不会发生改变,所以剩余溶液的浓度不变。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《海水资源的.. | |