微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将铜银合金投入到稀HNO3溶液中,发生如下反应:
aCu+bAg+cNO3-+dH+=eCu2++fAg++gNO↑+hN2O↑+mH2O,下列关系式错误的是(? )
A.d-c="2a+f"
B.2e+b="3g+8h"
C.反应中消耗的硝酸的物质的量为(2e+f+g+h)mol
D.d="4g+10h"
参考答案:C
本题解析:略
本题难度:简单
2、选择题 已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
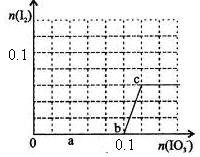
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
参考答案:C
本题解析:还原性HSO-3>I-,所以首先发生的离子反应是3HSO3-+IO3-=3SO42-+I-+3H+。继续加入KIO3,已知氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-=3H2O+3I2,根据发生的反应,则:A、根据图像可知,0~b间没有单质碘生成,所以反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+,A正确;B、根据图像可知,a点碘酸钾的物质的量是0.04mol,所以根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,消耗NaHSO3的物质的量为0.04mol×3=0.12mol,B正确;C、设生成的碘单质的物质的量为n,则溶液中I—的物质的量是2.5n。则根据反应IO3-+6H++5I-=3H2O+3I2可知,消耗的KIO3的物质的量为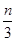 ,消耗碘离子的量为
,消耗碘离子的量为 。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol-
。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol- =2.5n,解得
=2.5n,解得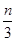 =
=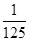 mol,所以消耗碘酸钾的物质的量是(
mol,所以消耗碘酸钾的物质的量是(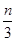 +0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。
+0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。
本题难度:一般
3、选择题 某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2mol该离子恰好能使0.6mol的SO32-离子完全氧化,则X2O72-离子还原后X的化合价为
A.+1
B.+2
C.+4
D.+3
参考答案:D
本题解析:设X2O72-被还原后X的化合价为x,0.2molX2O72-能使0.6molSO32-完全氧化成SO42-,其中S元素的化合价由+4价升高为+6价,所以由电子守恒可知,0.2mol×2×(6-x)=0.6mol×(6-4),解得x=+3,答案选D。
本题难度:一般
4、选择题 用水热法制备Fe3O4纳米颗粒的总反应如下:
3Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是(?)
A.在反应中1molO2氧化了3mol Fe2+
B.还原剂是Fe2+,氧化剂是S2O32-和O2
C.每生成1mol Fe3O4,转移3mol电子
D.当转移1mol电子时,消耗56gS2O32-
参考答案:D
本题解析:考查氧化还原反应相关知识点
反应中两个亚铁离子的化合价由+2价升至+3价(Fe3O4中有两个+3价铁), S2O32-中的四个硫全部转变为S4O62-,总体化合价由+8价升至+10价,升高2价,共升高四价;而氧气中氧元素由0价降至—2价,降低四价,反应中有四个电子的转移
所以还原剂为Fe2+、2S2O32-,氧化剂为O2
A:1molO2氧化了2mol Fe2+
B:还原剂为Fe2+、2S2O32-,氧化剂为O2
C:每生成1mol Fe3O4,共转移4mol电子
D:由反应可看出,当有4mol电子转移时,消耗2molS2O32-,即224g,正确
答案为D
本题难度:一般
5、填空题 铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g)?△H=-768.2kJ·mol-1,①
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g)?△H=+116.0kJ·mol-1,②
①热化学方程式:Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4?。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)="1" mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
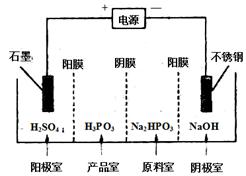
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
参考答案:(16分)(1)①Cu2S(s)+O2(g)=2Cu(s)+SO2(g)?△H=-217.4KJ/mol;(2分)
②阳;(2分)
(2)①H3PO2(2分);②1mol(2分);
(3)①c(CuCl2)>c(CuCl+)>c(CuCl3-)(2分);
②Cu2++Cl-═CuCl+(2分).
(4)①4OH--4e-=2H2O+O2↑(2分)
②HPO32-+2H+=H3PO3(2分)
本题解析:(1)①根据盖斯定律可得Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H=(①+②)/3=(-768.2kJ·mol-1+116.0kJ·mol-1)/3=-217.4KJ/mol;
②粗铜精炼时,粗铜作阳极,纯铜作阴极;
(2)①根据还原剂的判断,元素化合价升高的物质作还原剂,在4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4?中P元素的化合价升高,所以还原剂是H3PO2;
②该反应中每生成4molCuH转移 12mol电子,所以每转移3 mol电子,生成CuH的物质的量为1mol;
(3)①由图可知,当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-);
②从图上可见,在c(Cl-)=1mol?L-1的氯化铜溶液中,主要是Cu2+与Cl-结合生成CuCl+,方程式为:Cu2++Cl-═CuCl+;
(4)①根据离子的放电顺序及溶液中离子的种类,在阳极放电的是氢氧根离子,所以阳极电极反应式为4OH--4e-=2H2O+O2↑;
②产品室中有亚磷酸生成,原料室中的磷酸氢根离子通过阴膜到达产品室,与通过阳膜到达产品室的氢离子结合生成亚磷酸,所以产品室中的离子方程式为HPO32-+2H+=H3PO3。
本题难度:一般