微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知:Fe2+能被稀硝酸氧化,反应方程式为:3Fe(NO3)2+4HNO3(稀)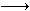 3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
硝酸体积(mL)
| 100
| 200
| 300
| 400
|
剩余固体(g)
| 18.0
| 9.6
| 0
| 0
|
放出气体的体积(mL)
| 2240
| 4480
| 6720
| ?
|
(1)由NO与HNO3的关系可知,稀硝酸的物质的量浓度为_______ mol·L-1。
(2)稀硝酸的密度为__________g/cm3。
(3)放出2240 mL气体时,反应的离子方程式是_____________________________,放出4480 mL气体时,消耗金属的质量为_______g。
(4)原混合物中铁和铜的物质的量比为__________。
(5)加入400 mL稀硝酸,反应完全后,溶液中NO3-的物质的量为________mol。
(6)当溶液中Cu2+、Fe2+的物质的量浓度相等时,放出气体的体积_________mL(标准状况下)。
参考答案:(本题共16分)
(1)? 4?(2分)?(2)? 1.26?(2分)
(3)? 3Fe+8H++2NO3-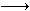 3Fe3++2NO↑+4H2O?(2分)? 16.8?(2分)
3Fe3++2NO↑+4H2O?(2分)? 16.8?(2分)
(4)? 2∶1?(2分)?(5)? 1.20?(3分)?(5)? 7840?(3分)
本题解析:略
本题难度:困难
2、选择题 向稀硫酸中加入铜粉不发生反应,若再加入某种盐,则铜粉可以逐渐溶解。符合此条件的盐是( )?
A.NaNO3
B.KCl
C.ZnSO4
D.Fe2(SO4)3?
参考答案:AD?
本题解析:加入NaNO3后,NO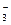 与溶液中的H+相当于HNO3,可以把Cu溶解,加入Fe2(SO4)3后,Fe3+也能与Cu反应。
与溶液中的H+相当于HNO3,可以把Cu溶解,加入Fe2(SO4)3后,Fe3+也能与Cu反应。
本题难度:简单
3、实验题 实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。根据要求回答下列问题:
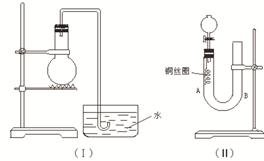
(1)用Ⅰ装置做实验时,实验过程中由于观察到烧瓶内有?现象,而不能有力证明反应产物是NO;收集NO能否用瓶口向上排空气法?答:?(填“能”“否”)。
(2)用Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到?为止。
a.刚好浸没铜丝下端? b.刚好浸没铜丝中部? c. 单孔塞下沿与液面间不留有空隙
②关闭活塞,用酒精灯对U形管的A侧加热,当?时,撤去酒精灯。
(3)在(2)的实验中:
①什么情况下反应自动停止???。
何处观察到无色的NO气体??。
②如果再将分液漏斗的活塞慢慢打开,可在分液漏斗中观察到哪些明显现象?
答:??。
参考答案:(1)烧瓶内有红棕色气体(2分)?否(2分)
(2)①C (3分)?②铜丝上有气泡产生(3分)
(3)①铜丝网与稀HNO3脱离后(2分)?在U型管A侧管中(2分)
②有红棕色气体出现(2分)
本题解析:(1)NO2可与水反应生成NO,为无色气体,烧瓶内有空气,与生成的NO很快被氧化为红棕色的NO2,不易观察到有无色的NO生成,答案:烧瓶内有红棕色气体;否
(2)①实验时应将装置内的空气完全排除,则应单孔塞下沿与液面间不留有空隙,否则不能观察到无色气体,
答案为:C 单孔塞下沿与液面间不留有空隙;
②铜丝与稀硝酸的反应为放热反应,当生成气体时可停止解热,反应放出的热量可维持反应继续进行,
答案为:铜丝上有气泡产生;
(3)①当铜丝和稀硝酸不接触时,反应会自动停止,在左侧可观察到无色气体,
答案为:当产生的NO气体将稀硝酸排入U型管B侧管内使铜丝网与稀硝酸脱离后反应会立即停止;在U型管A侧管内可观察到无色的NO气体;
②如果再将分液漏斗的活塞慢慢打开,右侧压强大于左侧,U型管B侧管中硝酸又回落到A侧管内,NO与空气接触而生成红棕色气体.
答案为:U型管B侧管中硝酸又回落到A侧管内,分液漏斗中有红棕色气体出现.
本题难度:一般
4、选择题 下列关于铵盐的叙述中不正确的是( )
A.由于含有离子键,所以都是离子化合物
B.受热都能分解出氨气
C.都易溶于水
D.都可以与碱反应放出氨气
参考答案:B
本题解析:铵盐含有离子键、共价键和配位键,含有离子键一定是离子化合物。铵盐不稳定,受热易分解,但不同铵盐受热分解产物不同。NH4NO3受热分解时,产物中没有NH3生成。C、D为铵盐的通性。
本题难度:简单
5、填空题 作为重要的工业三酸之一,硝酸通常有以下两种制取方法:
I.硝酸盐与浓硫酸反应: ?
?
II.氨的催化氧化法,其主要步骤为:①氨的催化氧化;② 氧化成
氧化成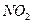 ;③水吸收
;③水吸收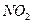
生成硝酸。
(1)方法l中不能加强热,其原因是?。(2)写出方法Ⅱ中步骤①的化学反应方程式?。(3)采用方法Ⅱ制取硝酸,若经过多次循环后,步骤②、③中氮元素的总利用率是
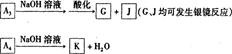
90%,某化工厂用1 t氨气制得5t63%的硝酸溶液,求步骤①中氨气的转化率?(书写计算过程,结果精确到0.1%)
参考答案:
(1)硝酸不稳定,如果采用强热条件,则会使生成的硝酸分解。
(2)
(3)步骤①中氨气的转化率为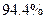 。
。
本题解析:
本题考查化工生产问题。(1)硝酸易分解,所以不能加强热;(2)该反应为氨气的催化氧化;(3)解:设步骤①中氨气的转化率为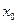 。?
。?
由N元素守恒可得:
 ————
————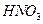
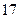 ?
?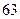
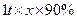 ?
?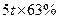
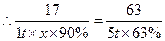 ?
?

本题难度:一般