|
|
|
高中化学必备知识点《电解池原理》高频试题预测(2017年最新版)(二)
2017-09-23 23:55:12
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如下图所示,其中甲池的总反应式为:2CH3OH + 3O2 + 4KOH=2K2CO3 + 6H2O,在接通电路一段时间后纯Cu质量增加了3.2 g。下列说法正确的是

[? ]
A.甲池是电能转化为化学能的装置,乙池是化学能转化电能的装置
B.甲池中理论上消耗标准状况下空气的体积是2.8 L(空气中O2体积分数以20%计算)
C.接通电路一段时间后,乙池中CuSO4溶液的浓度发生了明显的变化
D.甲池通入CH3OH的电极反应为:CH3OH-6e-+ 2H2O=CO32-+ 8H+
参考答案:B
本题解析:
本题难度:一般
2、选择题 近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的化学方程式为:KI+3H2O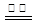 KIO3+3H2↑。下列有关说法不正确的是 ( ) KIO3+3H2↑。下列有关说法不正确的是 ( )
A.电解转移3 mol e-时,理论上可制得KIO3 107 g
B.电解时, 石墨作阳极,不锈钢作阴极
C.电解时的阳极电极反应式:I-?6e-+3H2O = IO3-+6H+
D.电解过程中电解质溶液的pH变小
|
参考答案:D
本题解析:A、每生成1mol KIO3,则转移6mol电子,所以转移3mol电子时生成0.5mol KIO3,其质量是107g,正确;B、电解时不锈钢作阴极,不能做阳极,否则Fe失去电子而被氧化,正确;C、电解时是I的化合价升高,所以I-在阳极发生氧化反应,生成IO3-,正确;D、电解过程中阳极产生氢离子,而阴极产生氢氧根离子,二者又结合成为水,所以电解质溶液的pH基本不变,错误,答案选D。
考点:考查电解原理的应用
本题难度:一般
3、填空题 按如图所示装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为______,B池为______.
(2)锌极为______极,电极反应式为______;铜极为______极,电极反应式为______;石墨棒C1为______极,电极反应式为______;石墨棒C2附近发生的实验现象为______.
(3)当C2极析出224mL气体(标准状况下),锌的质量变化为(增加或减少)______g.CuSO4溶液的质量变化为(增加或减少)______g.
(4)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.以下说法正确的是______
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子.
参考答案:该装置中A能自发的进行氧化还原反应为原电池,B为电解池,锌易失电子作负极,铜作正极,B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,阴极上氢离子放电;A中锌电极上失电子生成锌离子进入溶液,铜电极上铜离子得电子生成铜单质,所以其电池反应式为Zn+Cu2+=Cu+Zn2+;
(1)A能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B有外接电源,属于电解池,故答案为:原电池;电解池;
(2)该装置中A能自发的进行氧化还原反应为原电池,B为电解池,锌易失电子作负极,电极反应为:Zn-2e-=Zn2+;铜作正极,溶液中铜离子得到电子生成铜,电极反应为:Cu2++2e-=Cu;B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,电极反应为:2Cl--2e-=Cl2↑;阴极上氢离子放电,电极反应为2H++2e-=H2↑,电极上有气体生成,溶液中水的电离平衡正向进行,氢氧根离子浓度增大,负极附近的溶液遇到酚酞变红色;
故答案为:负;Zn-2e-=Zn2+;正;Cu2++2e-=Cu;阳;2Cl--2e-=Cl2↑;有无色气体产生;附近溶液出现红色;
(3)石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,其电极方程式为:4H2O+4e-=2H2↑+4OH-,当C2极析出224mL气体(标准状态)时,生成氢气的物质的量为n(H2)=0.224L22.4L/mol=0.01mol,则转移的电子为0.02mol,Zn电极的方程式为:Zn-2e-=Zn2+,根据电子守恒可知,消耗的Zn为0.01mol,则锌的质量减少0.65g,
CuSO4溶液的质量变化,依据化学方程式和溶液质量变化计算,B装置中的离子方程式;
Zn+Cu2+=Cu+Zn2+,溶液质量增加△m
1 65g-64g=1g
0.01mol 0.01g
CuSO4溶液的质量变化为增加0.01g;
故答案为:减少0.65,增加0.01;
(4)A.若Fe为阳极,则氯离子不能在阳极生成,则不会存在产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,故A错误;
B.电解时阳极附近氯离子放电,溶液的pH不会升高,故B错误;
C.电解时阳极附近氯离子放电,发生电极反应为2Cl--2e-═Cl2,故C正确;
D.由Ni2+-e-═Ni3+可知1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子,故D正确;
故选:CD.
故答案为:CD;
本题解析:
本题难度:一般
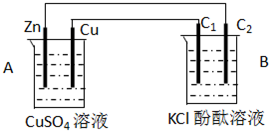
4、选择题 如图a、b、C.d均为石墨电极,通电进行电解.
下列说法正确的是( )
A.甲中a的电极反应为:4OH--4e-=O2↑+2H2O
B.电解时向乙中滴入酚酞试剂,C电极附近变红
C.向乙中通人适量HCl气体溶液组成可以恢复
D.当b极有64gCu析出时,C电极产生2g气体
|
参考答案:由图可知,甲中a与电源正极相连,则a为阳极,b为阴极;乙中c为阳极,d为阴极;电极是惰性电极,溶液中的离子放电,依据离子放电顺序写出电极反应进行分析判断,
甲中发生2CuSO4+2H2O ?通电?.?2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O ?通电?.?2NaOH+H2↑+Cl2↑;
甲池中阳极a电极反应:4OH--4e_=2H2O+O2↑;阴极b电极反应为:2Cu2++4e-=2Cu;
乙池中的阳极c电极反应为:4Cl--4e-=2Cl2↑;阴极d电极反应为:4H++4e-=2H2↑;
A、甲中a的电极反应为:4OH--4e-=O2↑+2H2O,故A正确;
B、乙池中的阳极c电极反应为:4Cl--4e-=2Cl2↑;阴极d电极反应为:4H++4e-=2H2↑;电解时向乙中滴入酚酞试剂,d电极附近变红,故B错误;
C、乙中发生2NaCl+2H2O ?通电?.?2NaOH+H2↑+Cl2↑;向乙中通人适量HCl气体溶液组成可以恢复,故C正确;
D、依据电极反应和电子守恒计算,b电极反应为,2Cu2++4e-=2Cu;c电极反应为:4Cl--4e-=2Cl2↑;当b极有64gCu物质的量为1mol析出时,电子守恒得到,2Cu~2Cl2↑;C电极产生71g气体,故D错误;
故选AC.
本题解析:
本题难度:一般
5、选择题 按如图所示装置进行下列不同的操作,说法不正确
的是?(?)
A.铁腐蚀的速度由大到小的顺序是:只接通K1>只
闭合K3>都断开>只闭合K2
B.只接通K1,一段时间后,U形管中出现白色沉淀
C.只接通K2,U形管左、右两端液面均下降
D.先只接通K1,一段时间后,漏斗液面上升,然后再
只接通K2,漏斗液面下降
参考答案:D
本题解析:只闭合K1,铁做阳极电解氯化钠溶液,铁失电子生成二价铁离子,氢离子在阴极得电子生成氢气和氢氧根离子,二者扩散到U形管底部相遇生成白色氢氧化亚铁沉淀,B项正确;只接通K2,铁做阴极,不能失电子,此时相当于惰性电极,该极生成氢气,石墨电极生成氯气,C项正确;综上分析只接通K1铁腐蚀最快,只闭合K3,形成原电池,铁腐蚀的速率次之,都断开时铁自然腐蚀,而只接通K2时为铁做阴极被保护,腐蚀速率最慢,A项正确。
本题难度:一般
