微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂。
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有?性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有?性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有?性。
(2)①在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44 L,则参加反应的铜片的质量为?(选填序号);
a.115.2 g? b.76.8 g? c.57.6 g? d.38.4 g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式:?。
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为:?。
参考答案:(1)(3分)强氧化?不稳定?挥发
(2)(3分)d(1分)? 3Cu + 8H+ + 2NO3—=3Cu2+ + 2NO↑+ 4H2O(2分)
(3)(2分)2Cl— — 2e—=Cl2↑
本题解析:(1)由于浓硫酸具有强氧化性,在常温下能使铝发生钝化,所以常温下,可用铝槽车装运浓硫酸;浓硝酸见光易分解生成NO2、氧气和水,所以硝酸应保存在棕色试剂瓶中;由于浓盐酸易挥发,所以敞口放置的浓盐酸浓度会减小。
(2)①标准状况下13.44L气体的物质的量=13.44L÷22.4L/mol=0.6mol,根据方程式2H2SO4(浓)+Cu  CuSO4+2H2O+SO2↑可知,参加反应的铜的物质的量是0.6mol,质量=0.6mol×64g/mol=38.4g,答案选d。
CuSO4+2H2O+SO2↑可知,参加反应的铜的物质的量是0.6mol,质量=0.6mol×64g/mol=38.4g,答案选d。
②由于随着反应的进行,浓硫酸的浓度逐渐降低。而铜与稀硫酸不反应,因此反应中硫酸过量。又因为在酸性条件下硝酸盐具有强氧化性,因此能氧化剩余的铜,反应的离子方程式为3Cu + 8H+ + 2NO3—=3Cu2+ + 2NO↑+ 4H2O。
(3)电解池中阳极失去电子,发生氧化反应。因此惰性电极电解饱和食盐水时阳极是氯离子放电,电极反应式为2Cl— — 2e—=Cl2↑。
本题难度:一般
2、选择题
A.NaOH和CuSO4
B.Ca(OH)2与H3PO4
C.NaOH与AlCl3
D.NaAlO2与HCl
参考答案:A
本题解析:逐项分析。
(1)不论NaOH过量,还是CuSO4过量,二者只按下式反应:
Cu2++2OH-====Cu(OH)2↓
即过量的NaOH或CuSO4,都不与生成的Cu(OH)2反应。A可选。
(2)①将Ca(OH)2向H3PO4滴加,开始时H3PO4过量,生成可溶于水的Ca(H2PO4)2,至H3PO4消耗完毕。随着Ca(OH)2的不断增加,Ca(H2PO4)2中的H+逐渐被中和掉,先后分别出现CaHPO4沉淀和Ca3(PO4)2沉淀。即开始不生成沉淀,后来生成沉淀。
将H3PO4向Ca(OH)2中滴加,开始时,Ca(OH)2过量,H3PO4被完全中和,生成Ca3(PO4)2沉淀,至Ca(OH)2消耗完毕。随着H3PO4的不断滴加,Ca3(PO4)2逐渐转化为CaHPO4,最后转化为可溶于水的Ca(H2PO4)2。即开始生成沉淀,后来沉淀溶解。B不可选。
(3)将NaOH(aq)滴入AlCl3(aq)中,开始产生沉淀,后来沉淀逐渐消失。将AlCl3(aq)滴入NaOH(aq)中,开始不产生沉淀,后来产生沉淀不消失。C不可选。
(4)将NaAlO2滴入稀盐酸中,开始无沉淀产生,后来产生沉淀不消失。将稀盐酸滴入NaAlO2溶液中,开始有白色沉淀产生,后来沉淀逐渐溶解。可见,D不可选。
本题难度:一般
3、实验题 (6分)已知Cl2+H2O  ?HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
?HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
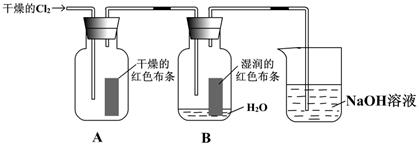
(1)通入Cl2后,从集气瓶A中干燥的红色布条没有褪色的现象可得出的结论是??;
从集气瓶B中湿润的红色布条的现象可得出的结论是??。
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是??。
参考答案:(6分,每空2分)
⑴干燥的氯气无漂白性;⑵潮湿的氯气具有漂白性;⑶HCl不能使湿润的红色布条褪色
本题解析:(1)干燥的红色布条没有褪色,说明干燥的氯气无漂白性。集气瓶B中湿润的红色布条褪色,说明潮湿的氯气具有漂白性。
(2)由于氯气和水反应还有氯化氢生成,所以还必须增加氯化氢能否使布条褪色的实验。
点评:该题属于基础性试题,难度不大。关键是注意要有对比实验,以增强实验的准确性和严密性。
本题难度:一般
4、填空题 氯气有毒,一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3氧化成N2)请简要说明这种检验方法的依据:?
?。并写出有关反应的化学方程式为?。
参考答案:Cl2与NH3反应生成HCl,HCl又与NH3反应生成NH4Cl小颗粒,而产生白烟;
3Cl2 + 2NH3 = N2 + 6HCl
HCl + NH3 = NH4Cl
本题解析:由题给信息:Cl2可将NH3氧化成N2,可知Cl2被还原为HCl,HCl又与NH3反应生成NH4Cl小颗粒,而产生白烟。
本题难度:简单
5、选择题 下列关于氯气的物理性质描述正确的是( )
A.无毒
B.无颜色
C.无气味
D.有刺激性气味
参考答案:氯气是一种黄绿色、有剧烈刺激性气味,密度比空气大,能溶于水,有毒的气体.
A.氯气人吸入少量,会使鼻和喉头的粘膜受到刺激,引起胸部疼痛和咳嗽,吸人大量会中毒死亡,氯气是有毒的气体,故A错误;
B.氯气是一种黄绿色的气体,故B错误;
C.氯气是有剧烈刺激性气味的气体,故C错误;
D.氯气是有剧烈刺激性气味的气体,故D正确;
故选D.
本题解析:
本题难度:简单