微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。已知:
化学键
| N≡N
| H—O
| N—H
| O=O
|
键能/kJ·mol-1
| 945
| 463
| 391
| 498
|
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:_____▲______;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
T/℃
| 30
| 40
| 50
|
生成NH3量/(10-6mo1/L)
| 4.8
| 5.9
| 6.0
|
①50℃时从开始到3 h内以O2物质的量浓度变化表示的平均反应速率为? ▲?;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条)? ▲?、? ▲?;
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:
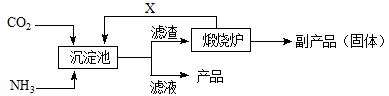
①往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
? ▲?。
②煅烧炉中产生的固态副产品为? ▲?,生产流程中能被循环利用的物质X为? ▲?。
2、选择题 绿色化学提倡化工生产应提高原子利用率。在下列制备环氧乙烷的反应中,原子利用率最高的是
[? ]
A.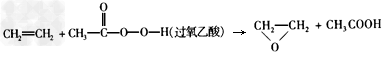
B.CH2=CH2+Cl2+Ca(OH)2→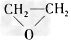 +CaCl2+H2O
+CaCl2+H2O
C.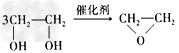 + HOCH2CH2-O-CH2CH2OH+2H2O
+ HOCH2CH2-O-CH2CH2OH+2H2O
D.2CH2=CH2?+?O2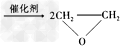 ?
?
3、填空题 (9分)酿酒和造醋是古代劳动人民的智慧结晶,白酒和醋也是日常生活中常见的有机物。
(1)醋酸可用于除去水壶中的水垢,成份主要是CaCO3和Mg(OH) 2。写出醋酸与Mg(OH) 2反应的离子方程式_______________________。食盐中常加入KIO3来补碘,为验证食盐中的KIO3,可在食盐中加入醋酸,再加入KI和淀粉溶液。反应的离子方程式为____________________________。
(2)酿制米酒的过程中是米中的淀粉在酶的作用下生成葡萄糖。写出化学方程式_____________________________,然后葡萄糖在酶的作用下生成乙醇。
(3)在酿制米酒的过程中,有可能变酸,这里因为产生了醋酸。为了除去米酒中的酸味有人建议向米酒中加入红热的铅,使它与醋酸生成有甜味的醋酸铅。你认为此法是否可行_____(填行,不可行),原因是___________________________________。
4、填空题 在18世纪40年代以前,生产硫酸最古老的方法是:以绿矾(FeSO4·7H2O)为原料在蒸馏中煅烧,然后再冷凝至室温,得到一种液体,称之为“绿矾油”。
(1)蒸馏釜所产生的气体中含有的成分是________________________。
(2)绿矾油的成分是________________________。
(3)绿矾油质量分数是________________________。
(4)留在蒸馏釜中的物质是________________________。
5、填空题 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图:
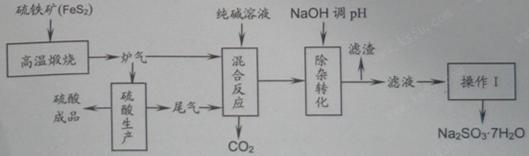
已知:①炉气、尾气中含有SO2;②混合反应中还溶解有少量Fe2O3、MgO等矿尘。
(1)煅烧1molFeS2放出热量为853kJ,则FeS2燃烧的热化学方程式为_____________。
(2)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为_____________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为_____________(任写一个)。
(4)通过“操作Ⅰ”可以得到亚硫酸钠晶体,写出主要操作步骤的名称:__________。
(3)硫酸生产中炉气转化反应为:2SO2(g)+ O2(g)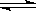 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
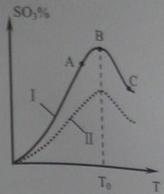
A.该反应的正反应为放热反应
B.曲线Ⅰ上A、C两点反应速率的关系是: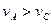
C.反应达到B点时,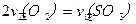
D.已知V2O5的催化效果比Fe2O3好,若Ⅰ表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线