微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在室温下,下列叙述正确的是( )
A.将1?mL?1.0×10-5mol/L盐酸稀释到1000?mL,得到pH=8?的盐酸
B.将1?mL?pH=3的一元酸溶液稀释到10?mL,若溶液的pH<4,则此酸为弱酸
C.用pH=1的盐酸分别中和1?mL?pH=13?NaOH溶液和氨水,NaOH消耗盐酸的体积大
D.pH=2的盐酸与pH=1的硫酸比较,2?c(Cl-)=c(SO42-)
参考答案:A、将1?mL?1.0×10-5mol/L盐酸稀释到1000?mL,得到盐酸pH接近7,不可能大于7,故A错误;
B、一元强酸稀释10倍,pH增大一个单位,一元弱酸稀释10倍,弱酸存在电离平衡,pH增大小于一个单位;将1mLpH=3的一元酸溶液稀释到10 mL,若溶液的pH<4,则此酸为弱酸,故B正确;
C、用pH=1的盐酸分别中和1mLpH=13的NaOH溶液和氨水,氨水存在电离平衡,所以氨水消耗盐酸的体积大,故C错误;
D、pH=2的盐酸与pH=1的硫酸比较,依据HCl=Cl-+H+;H2SO4=2H++SO42-;c(Cl-)=0.01mol/L,而c(SO42-)=0.05mol/L,即5c(Cl-)=c(SO42-),故D错误;
故选B.
本题解析:
本题难度:简单
2、选择题 将标准状况下NO2和O2按体积比4:1混合后充入一干燥烧瓶中,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液溶质的物质的量浓度为( )
A.
mol?L-1
B.×mol?L-1
C.×mol?L-1
D.mol?L-1
参考答案:设混合气体中含有4VLNO2,1VLO2,则烧瓶的体积为5VL,
? ?4NO2+O2+2H2O=4HNO3
4V22.4mol? V22.4mol? V22.4mol
c(HNO3)=4V22.4mol5VL=45×122.4mol/L,
故选C.
本题解析:
本题难度:一般
3、简答题 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为______?mol/L.若用KMnO4氧化上述?HCl.其反应方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)该反应中的氧化剂是______.
(3)表现还原性的HCl与表现酸性的HCl的质量之比是______
(4)1mol?KMnO4完全反应,被氧化的HCl的物质的量为______mol.
(5)8mol?HCl完全反应,产生的Cl2在标准状况下的体积为______升.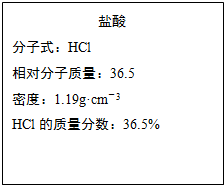
参考答案:(1)C=103ρwM=103×1.19×36.5%36.5=11.9mol/L,故答案为:11.9;
(2)该反应中锰元素的化合价由+7价得电子变为+2价,所以高锰酸钾作氧化剂,故答案为:KMnO4;
(3)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,根据原子守恒知,化合价变化的氯化氢的计量数是10,化合价不变的氯化氢的计量数是6,所以表现还原性的HCl与表现酸性的HCl的质量之比是10:6=5:3,故答案为:5:3;
(4)设被氧化的氯化氢的物质的量是x.
2KMnO4+10 HCl(浓)(作还原剂)+6HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
?2mol?10mol
?1mol? x
x=5mol
故答案为:5;
(5)设生成氯气的体积是y.
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
? 16mol? 112L
? 8mol? y
y=56L,
故答案为:56.
本题解析:
本题难度:一般
4、选择题 200mlFe2(SO4)3溶液中含Fe3+56g,溶液中SO42-的物质的量浓度是( )
A.5mol/L
B.7.5?mol/L
C.10?mol/L
D.2.5?mol/L
参考答案:56gFe3+的物质的量为56g56g/mol=1mol,溶液中n(SO42-)=32n(Fe3+)=32×1mol=1.5mol,所以溶液中SO42-的物质的量浓度1.5mol0.2L=7.5mol/L.
故选B.
本题解析:
本题难度:简单
5、选择题 2011年3月日本发生里氏9.0级大地震,假若你是卫生防疫人员,为配制0.01 mol/L的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是
[? ]
A.取KMnO4样品时不慎在表面沾了点蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶刻度线
D.摇匀后见液面下降,再加水至刻度线
参考答案:C
本题解析:
本题难度:一般