微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各项中的两个量,其比例为2:1的是(?)
A.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比
B.同温度下,0.2mol/LCH3COOH溶液与0.1mol/L CH3COOH溶液中的c(H+)之比
C.液面在“0”刻度,50mL酸式滴定管和25mL酸式滴定管内所盛溶液的体积
D.0.2mol/L的NaHSO3溶液中的阳离子与阴离子的浓度之比
参考答案:A
本题解析:略
本题难度:简单
2、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4溶液与Na2CO3溶液主要反应:Cu2++CO32-+H2O ==Cu(OH)2↓+CO2↑
次要反应:Cu2+ +CO32- ==CuCO3↓,
(2) CuSO4溶液与Na2S溶液主要反应:Cu2+ +S2- ==CuS↓,
次要反应:Cu2+ +S2- +2H2O==Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
[? ]
A. CuS < Cu(OH)2 < CuCO3
B. CuS > Cu(OH)2 > CuCO3
C. Cu(OH)2 > CuCO3 > CuS
D. Cu(OH)2 < CuCO3 < CuS
参考答案:A
本题解析:
本题难度:一般
3、计算题 (17分)随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为为______,外电路中电子从______到______(填“A”或“B”)移动,写出电池负极的电极反应方程式?
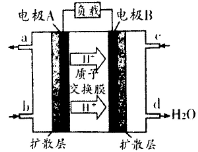
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(0H)3沉淀。
①反应中,1molCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为_________ mol。
②常温下,Cr(OH)3的溶度积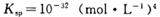 ,当Cr3+浓度小于10
,当Cr3+浓度小于10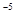 mol
mol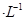 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
(3)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,溶液中 ________(填“增大”“减小”或“不变”);25
________(填“增大”“减小”或“不变”);25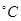 时,NH3?H2O的电离平衡常数
时,NH3?H2O的电离平衡常数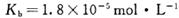 ,该温度下,1mol
,该温度下,1mol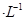 的NH4Cl溶液中
的NH4Cl溶液中
参考答案:(17分)
(1)O2(2分)? AB(2分) CH3OH—6e?+H2O=CO2+6H+(3分)
(2)①12(3分)?②能(2分)
(3)不变(2分)? 2.36×10-5(3分)
本题解析:(1)电池内部阳离子向正极移动,根据题目所给示意图,H+向电解B移动,则电极B为正极,所以C处通入的物质为O2;外电路电子从负极向正极移动,所以从A到B移动;根据示意图可知电解液中含H+,负极上甲醇失去电子生成CO2和H+,所以电极方程式为:CH3OH—6e?+H2O=CO2+6H+
(2)①处理铬污染的原理是Fe做阳极发生反应:Fe—2e?=Fe2+,Cr2O72?氧化Fe2+,Cr2O72?被还原为Cr3+,根据化合价的变化,对应关系为:Cr2O72?~ 6Fe2+ ~6Fe,1molCr2O72-完全生成Cr(OH)3沉淀,阳极反应的Fe为6mol,外电路通过电子的物质的量为12mol。
②溶液的pH=6,则c(OH?)=10-8mol?L?1,带入溶度积公式可得:c(Cr3+)(10-8mol?L?1)3=10-32(mol?L?1)4,解得c(Cr3+)=10-8mol?L?1 < 10-5mol?L?1,能直接排放。
(3)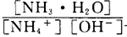 为NH4+水解平衡常数的倒数,NH4Cl溶液中加入少量NaOH,平衡常数不变,则该比值不变;根据盐类的水解与弱电解质电离的关系,水解平衡常数Kh=Kw/Kb=1.0×10-14mol2/L2÷(1.8×10-5mol?L?1)=5.56×10-10mol?L?1,则c(NH3?H2O)?c(H+)/c(NH4+)=5.56×10-10mol?L?1,因为c(NH3?H2O)≈c(H+),c(NH4+)≈1mol?L?1,带入计算式可得c(H+)=2.36×10-5mol?L?1。
为NH4+水解平衡常数的倒数,NH4Cl溶液中加入少量NaOH,平衡常数不变,则该比值不变;根据盐类的水解与弱电解质电离的关系,水解平衡常数Kh=Kw/Kb=1.0×10-14mol2/L2÷(1.8×10-5mol?L?1)=5.56×10-10mol?L?1,则c(NH3?H2O)?c(H+)/c(NH4+)=5.56×10-10mol?L?1,因为c(NH3?H2O)≈c(H+),c(NH4+)≈1mol?L?1,带入计算式可得c(H+)=2.36×10-5mol?L?1。
本题难度:一般
4、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
A.CuS<Cu(OH)2<CuCO3
B.CuCO3<Cu(OH)2<CuS
C.CuS<CuCO3<Cu(OH)2
D.Cu(OH)2<CuCO3<CuS
参考答案:A
本题解析:沉淀反应中,生成物的溶解度越小,沉淀反应越容易发生,
(1)主要发生Cu2++CO32─+H2O=Cu(OH)2↓+CO2↑,次要发生Cu2++CO32─=CuCO3↓,可说明Cu(OH)2溶解度小于CuCO3的溶解度,
(2)主要:Cu2++S2─=CuS↓,次要:Cu2++S2─+2H2O=Cu(OH)2↓+H2S↑,可说明CuS的溶解度小于Cu(OH)2的溶解度,
则溶解度CuS<Cu(OH)2<CuCO3, 故选A.
本题难度:一般
5、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(?)
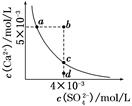
A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
参考答案:C
本题解析:A项只有在单一CaSO4溶液中c(Ca2+)、c(SO42-)才相等,A项错误;B项b点Qc>Ksp,故有沉淀生成,开始c(Ca2+)、c(SO42-)不相等而反应消耗的Ca2+、SO42-相等,因此平衡后的两种离子也不会都等于3×10-3 mol/L,B项错误;在平衡线上的Ksp均相等,C项正确;D项d点通过蒸发后各离子浓度都增大,不可能保持SO42-浓度不变而到达c点,D项错误。
本题难度:一般