微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (8分)将0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量。
(1)写出上述反应的热化学方程式。
(2)已知H2O(l)转化为H2O(g)的△H=44KJ.mol_1,试计算11.2L(标准状况下)气态乙硼烷完全燃烧生成气态水时放出的热量。(请写出计算过程)
2、填空题 阅读下列资料,回答问题:
“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。 工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,二者的体积比约为 1:1。 已知:1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出 286 kJ热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学反应方程式_____________。若1 mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量 ___________(填“>”“=”或“<”)890 kJ。
(2)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为 _____________;燃烧生成的CO2的质量比约为________________。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是_________________。
3、选择题 下列热化学方程式书写正确的是
[ ? ]
A.2SO2+O2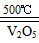 2SO3 △H=-196.6kJ·mol-1
2SO3 △H=-196.6kJ·mol-1
B.H2(g)+1/2O2(g)====H2O(l) △H=-285.8kJ·mol-1
C.2H2(g)+O2(g)====2H2O(l) △H=-571.6kJ
D.C(s)+O2(g)====CO2(g) △H=+393.5KJ·mol-1
4、填空题 (16分)制备氢气可利用碘硫热化学循环法,其原理示意图如下。

(1)已知:①2SO3(g) 2SO2 (g) + O2 (g) △H1
2SO2 (g) + O2 (g) △H1
②H2SO4(l) SO3(g) + H2O(l) △H2
SO3(g) + H2O(l) △H2
2H2SO4(l) 2SO2 (g) + O2(g) +2H2O(l) △H3
2SO2 (g) + O2(g) +2H2O(l) △H3
则△H3= (用△H1和△H2表示)
(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是 。
(3)碘化氢热分解反应为:2HI(g) H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
(4)本生(Bunsen)反应中SO2和I2及H2O发生反应为:
SO2+I2+2H2O=3H++HSO4─+2I─;I─+I2 I3─。
I3─。
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如下图,图中a、b分别表示的离子是 、 。

②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。写出浓硫酸与HI发生反应生成硫和碘的化学方程式: 。
5、填空题 镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) △H3
则△H3 = kJ·mol-1。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4Cl·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为 。
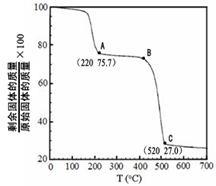
(4)工业上用MgC2O4·2H2O热分解制超细MgO,其热分解曲线如图。
图中隔绝空气条件下B→C发生反应的化学方程式为 。
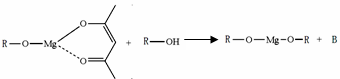
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为: ,它可发生如下反应:
,它可发生如下反应:
ROH与B的核磁共振氢谱如下图:

ROH由C、H、O、F四种元素组成的含氟有机物,分子中只有1个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为 ; B的结构简式为 。