微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 配制250ml1mol/LH2SO4溶液所要用的溶解仪器是______,定容仪器是______,用于引流的是______,用于加水使溶液的凹液面跟刻度线相切的是______.
参考答案:操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到250mL容量瓶中(配制250mL溶液,需要选择250mL规格容量瓶),并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管加水使溶液的凹液面跟刻度线相切,最后定容颠倒摇匀,
故配制250ml1mol/LH2SO4溶液所要用的溶解仪器是:烧杯;定容仪器是:250mL容量瓶;用于引流的是:玻璃棒;用于加水使溶液的凹液面跟刻度线相切的是:胶头滴管;
故答案为:烧杯;250ml容量瓶;玻璃棒;胶头滴管.
本题解析:
本题难度:简单
2、选择题 向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液
甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( ?)
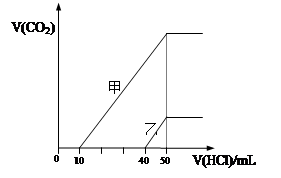
A.原NaOH溶液的物质的量浓度为0.5 mol·L-1
B.当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为: OH-+H+=H2O
C.乙溶液中含有的溶质是NaOH、NaHCO3
D.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况)
参考答案:A
本题解析:A、HCl加入50ml时,恰好反应生成NaCl,根据Na元素和Cl元素守恒,HCl的物质的量等于NaOH的物质的量,所以c(NaOH)=0.05L×0.1mol/L÷0.01L=0.5mol?L?1,正确;B、根据甲的图像可知,甲溶液含有Na2CO3和NaHCO3,所以0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为:CO32?+H++=HCO3?,错误;C、根据乙的图像可知,乙溶液含有NaOH和Na2CO3,错误;D、当乙溶液加入的HCl体积 40<V(HCl)<50mL时,发生反应:HCO3?+H+=CO2↑+H2O,V(CO2)=0.01L×0.1mol/L×22.4L/mol=0.0224L=22.4mL,错误。
本题难度:一般
3、选择题 同温同压下,等质量的O2和O3相比较,下列结论正确的是
A.它们的分子数目之比是 1∶1
B.它们的密度之比为 2∶3
C.它们的体积之比是 1∶1
D.它们的氧原子数目之比为 2∶3
参考答案:B
本题解析:A、同条件下等质量的O2和O3的分子数目之比也即摩尔质量的反比,即48:32=3:2,错误;B、它们的密度之比也即体积的反比或者换算为物质的量之比,即2:3,正确;C、它们的体积之比即为物质的量之比,应为2:3,错误;D、质量相同,所以它们的氧原子数目之比为1:1,错误,答案选B。
本题难度:一般
4、填空题 (8分)现有HNO3和NaNO3的混合溶液200mL,其中 HNO3和NaNO3的物质的量浓度均为1 mol/L。若要使 HNO3和NaNO3的物质的量浓度分别为2 mol/L 和0.2 mol/L,应加入63%的浓硝酸(密度为1.2g/cm3)________mL,再加入蒸馏水稀释至_______mL才能实现。
参考答案: 150 1000
本题解析:解:硝酸钠的物质的量不变,根据稀释定律,令混合稀释后溶液的体积为V,则:200mL×1mol?L-1=V×0.2mol?L-1,解得V=1000mL,故需加入蒸馏水稀释至1000毫升才能实现;混合后溶液中n(HNO3)=1L×2mol?L-1=2mol,故加入的硝酸的物质的量为:2mol-0.2L×1mol?L-1=1.8mol,63%的浓硝酸的物质的量浓度c=1000×1.2×63%/63mol/L=12mol/L,故需要加入63%的浓硝酸溶液的体积为1.8/12=0.15L=150mL。
考点:考查物质的量浓度的相关计算。
本题难度:一般
5、实验题 实验室用氯化钠固体配制1.00mol·L-1的NaCl溶液500mL,回答下列问题
(1)请写出该实验的实验步骤
①计算,② ,③溶解,④ ,⑤洗涤⑥定容,⑦摇匀。
(2)所需仪器为:容量瓶(规格: )、托盘天平,胶头滴管还需要那些玻璃仪器才能完成该实验,请写出 , ,胶头滴管
(3)试分析下列操作对所配溶液的浓度有何影响。(填空:A---偏高、B---偏低、C---无影响,填序号)
①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。对所配溶液浓度的影响:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响 。
③配制前容量瓶用水洗涤后未进行干燥处理__________。
参考答案:(1)②称量,④移液,
(2)500mL 烧杯、 玻璃棒、
(3)①A ②B ③C
本题解析:(1)一般溶液配制的过程可以总结为①计算,②称量,③溶解,④移液,⑤洗涤
⑥定容 ,⑦ 摇匀。(2)容量瓶选择的时候要注意规格(3)溶液体积热胀冷缩,当温度高的时候进行定容,温度回到正常时,溶液体积变小,导致浓度偏大。摇匀后所得溶液浓度正好,但由于有些溶液会残留在玻璃塞处,若此时加入蒸馏水,会导致浓度偏低。配制中,要向容量瓶中加入蒸馏水,所以配制前容量瓶中是否残留蒸馏水(是否干燥)对最终的浓度没有影响。
考点:考查溶液配制的方法,仪器及误差分析
本题难度:一般