微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 目前,全世界镍(Ni)的消费量仅次于铜、铝、铅、锌,居有色金属第五位,镍行业的发展蕴藏着巨大的潜力。
(1)基态Ni原子的核外电子排布式为__________________
(2)已知配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,则固态Ni(CO)4属于_______晶体。
(3)某配合物结构如图所示,其分子内含有的作用力有____(填编号)。
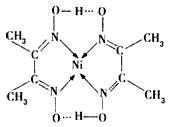
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)很多不饱和有机物在Ni催化下可与H2发生加成反应,CH2=CH2就是其中的一种。CH2=CH2中含有
_____个π键,其中C原子的杂化方式为_________。
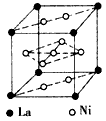
(5)氢气是新型清洁能源,镧(La)和镍的合金可作储氢材料。该合金的晶胞如图所示,晶胞中心有一镍原 子,其他镍原子都在晶胞面上。该晶体的化学式是____________。
参考答案:(1)1s22s22p63s23p63d84s2或[Ar]3d84s2
(2)分子
(3)ACE
(4)1;sp2杂化
(5)LaNi5或Ni5La
本题解析:
本题难度:一般
2、填空题 1919年,Langmui提出等电子原理:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。
(1)CNS-、NO2+具有相同的通式:AX2,它们的价电子总数都是16,因此它们的结构与由第二周期两元素组成的_______分子的结构相同,微粒呈_______形,中心原子取_______杂化轨道。
(2)CO32-、NO3-等微粒的总价电子数都等于________,呈_______形,中心原子都取_______杂化。
参考答案:(1)CO2;直线形;sp
(2)24;平面正三角形;sp2
本题解析:
本题难度:一般
3、选择题 下列分子中心原子是sp2杂化的是?
[? ]
A.PBr3?
B.CH4?
C.BF3?
D.H2O
参考答案:C
本题解析:
本题难度:简单
4、填空题 (三选一)【物质结构与性质】
(1)金属钛(22Ti)将是继铜、铁、铝之后人类广泛使用的第四种金属,写出钛元素的基态原核外电子排布式:_______________
(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未成对电子数为_____________。
(3)COCl2俗称光气,分子中碳原子采取_____________杂化成键;其中碳氧原子之间的共价键含有____(填字母)。
a.2个σ键 b.2个π键 c.1个σ键、1个π键
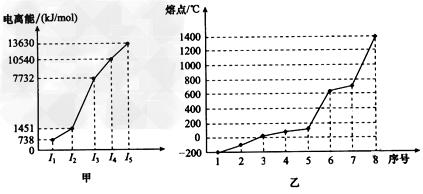
(4)①短周期某主族元素M的逐级电离能情况如图甲所示,则M元素形成化合物时表现的主要化合价为______价。
②第三周期8种元素按单质熔点高低的顺序如图乙所示,其中序号“8”代表_______(填元素符号,下同);其中电负性最大的是_________。
(5)由碳原子跟硅原子以1:1相互交替结合而形成的晶体,晶型与晶体Si相同。两者相比熔点更高的是________(填化学式),试从结构角度加以解释:______________
(6)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是_________________
参考答案:(1)1s22s22p63s23p63d24s2
(2)6
(3)sp2;c
(4)①+2;②Si;Cl
(5)SiC;SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键的键长比晶体Si中Si-Si键的键长短,键能大,因而熔沸点更高
(6)Fe3+
本题解析:
本题难度:一般
5、填空题 生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式____。
(2)根据等电子原理,写出CO分子的结构式____。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是___ ;甲醛分子中碳原子轨道的杂化类型为_______________。
②甲醛分子的空间构型是_____;1 mol甲醛分子中σ键的数目为__________________。
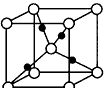
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________。
参考答案:(1)
(2)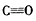
(3)①甲醇分子之间形成氢键sp2杂化;②平面三角形3NA; ③4
本题解析:
本题难度:一般