微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
(1)Ni在元素周期表中的位置是______.
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+?等.写出一种与配体CO互为等电子体的阴离子______.配体NH3中N原子的杂化类型为______,它可用作致冷剂的原因是______.若[Ni(NH3)6]2+?为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有______种.
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2?价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为______,NiO(OH)溶于浓盐酸的化学方程式为______.
(4)镍和镧(
La)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2.LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6.LaNixH6中,x=______.该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
LaNixHy+y?NiO(OH)?LaNix+y?NiO+y?H2O.写出其放电时负极的电极反应方程式______.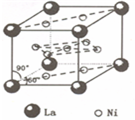
参考答案:(1)Ni的原子数序为28,位于周期表第四周期第Ⅷ族,故答案为:第四周期,第Ⅷ族;
(2)CO的电子数为14,含有2个原子,它的等电子体有等CN-、C22-;NH3中N原子形成4个δ键,为杂化sp3;氨气易液化,液化时吸收大量的热,可用作制冷剂;[Ni(CO)2(NH3)4]2+的结构中,CO可位于平面的相邻和相对两种位置,
故答案为:CN-、C22-;sp3;液态氨汽化时需吸收大量的热;2;
(3)Ni3+的电子排布式为:[Ar]3d7或1s22s22p63s23p63d7,NiO(OH)具有氧化性,与盐酸发生氧化还原反应,化学方程式为2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O,
故答案为:[Ar]3d7或1s22s22p63s23p63d7;2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O;
(4)由晶胞结构可知,Ni位于晶胞的面上,共有10个Ni,则平均含有Ni的个数为10×12=5,原电池负极发生氧化反应,由原电池总反应式可知,负极反应式为LaNi5H6+6OH--6e-═LaNi5+6H2O,
故答案为:5;?LaNi5H6+6OH--6e-═LaNi5+6H2O.
本题解析:
本题难度:一般
2、选择题 正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构.层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中B原子杂化轨道的类型为sp3
D.含1mol H3BO3的晶体中有3mol氢键
