| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《水的电离平衡》高频试题强化练习(2017年最新版)(八)
参考答案:(1)①②④③(或②①④③)。(2)A、C;玻璃棒、烧杯。(3)B。 本题解析:(1)首先配制需要的标准浓度的溶液,取待测物制成溶液,在待测物溶液中加入一定量的盐酸,再用氢氧化钠进行滴定,所以顺序为:①②④③(或②①④③)。(2)配制溶液需要容量瓶,量筒,胶头滴管,烧杯,玻璃棒,不需要平底烧瓶和分液漏斗,所以选A、C;图上还缺少玻璃棒、烧杯。(3)因为每次实验至少使用25毫升溶液,两次就需要50毫升,所以至少需要配制溶液各100毫升,选B。(4)过程中涉及了碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,盐酸和氢氧化钠反应生成氯化钠和水,所以方程式为:(4)CaCO3+2HCl=CaCl2+CO2+H2O HCl+NaOH=NaCl+H2O 本题难度:一般 2、实验题 (9分)用中和滴定法测定某烧碱的浓度。请回答在主要操作过程中的有关问题:
(3)若该学生测定值偏大了,则引起测定误差的可能原因是_______________________ A.酸式滴定管用水洗后,未用标准酸液润洗 B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失 C.锥形瓶用蒸馏水洗后,未用碱液洗 D.酸式滴定管起始读数俯视,滴定后读数仰视 E.在滴定过程中向锥形瓶中添加少量蒸馏水 F.取待测液时,碱式滴定管未用碱液洗 G.当指示剂局部变色时,停止滴定 参考答案:(9分)(1)酚酞或甲基橙 ; 锥形瓶内溶液颜色变化 ; 当溶液突然由红色变为无色(或黄色变为橙色),且30秒后颜色不恢复; (各1分,共3分) 本题解析:略 本题难度:一般 3、填空题 (12分)(1)25℃时,pH=12.0的KOH溶液中,由水电离出的c(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的c(OH-)=_______mol/L。 参考答案:(1)1×10-12 1×10-2 (2) CH3COO- + H2O 本题解析:(1)酸、碱抑制水电离,含有弱根离子的盐促进水电离,碱溶液中水电离出的c(OH-)=c(H+)=10-12 mol/L,K2CO3是强碱弱酸盐,促进水电离,溶液中水电离出的c(OH-) 为水的离子积常数与c(H+)的比,所以水电离出来的c(OH-)=10?14/10?12mol/L=10-2 mol/L。 本题难度:一般 4、选择题 下列电离方程式中正确的是 参考答案:D 本题解析: 本题难度:简单 5、选择题 对水的电离平衡不产生影响的粒子是 | ||||||||||||||||||
参考答案:B
本题解析:H2O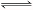 H++OH-,氢离子和氢氧根离子浓度增大,会抑制水的电离,弱酸根离子和弱碱根离子能发生水解反应,促进水的电离,故只有氯离子对水的电离无影响,答案选B.
H++OH-,氢离子和氢氧根离子浓度增大,会抑制水的电离,弱酸根离子和弱碱根离子能发生水解反应,促进水的电离,故只有氯离子对水的电离无影响,答案选B.
考点:水的电离
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《氧化还原反应中的.. | |