微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
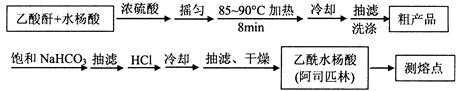
1、实验题 阿司匹林(乙酰水杨酸,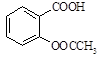 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
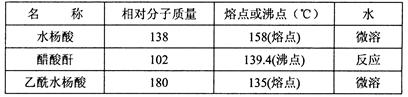
主要试剂和产品的物理常数
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,最合适的加热方式是?。
②抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是?。
(2)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是?。
另一种改进的提纯方法,称为重结晶提纯法。方法如下:
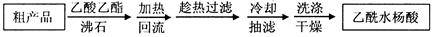
(3)改进的提纯方法中加热回流的装置如图所示,
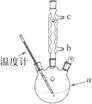
①使用温度计的目的是?。冷凝水的流进方向是?。(填“b”或“c”)。
②重结晶提纯法所得产品的有机杂质要比原方案少的原因?。
(4)检验产品中是否含有水杨酸的化学方法是?。
(5)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=2.2 g,则所得乙酰水杨酸的产率为?。
参考答案:
(1)① 水浴加热
② 关小水龙头,向布氏漏斗中加蒸溜水至浸没沉淀物,待洗液完全滤出,洗涤2-3次。
(2)使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,与不溶性杂质分离
(3)① 控制反应温度,防止乙酰水杨酸受热分解;? b
② 水杨酸等有机杂质易溶于乙酸乙酯,冷却结晶时溶解在乙酸乙酯中很少结晶出来
(4)取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若溶液呈紫色则含水杨酸
(5)84.6%
本题解析:(1)①乙酰水杨酸受热易分解,分解温度为128~135℃,所以合成阿斯匹林时,最合适的加热方式是水浴加热。②水杨酸微溶解于水,温度越高,溶解度越大。所以为了要得到纯净的阿斯匹林抽滤所得粗产品要用少量冰水洗涤。洗涤的具体操作是关小水龙头,向布氏漏斗中加蒸溜水至浸没沉淀物,待洗液完全滤出,洗涤2-3次。(2)由于酸性乙酰水杨酸>H2CO3,所以加饱和NaHCO3溶液可以与乙酰水杨酸发生反应得到容易溶解于水的乙酰水杨酸钠,便于同步溶性的杂质分离。(3)①使用温度计的目的是控制反应温度,防止乙酰水杨酸受热分解。为了使冷凝效果提高,要使冷却水充满整个冷凝管。所以冷凝水的流进方向是b. ②重结晶提纯法所得产品的有机杂质要比原方案少是因为水杨酸等有机杂质易溶于乙酸乙酯,冷却结晶时溶解在乙酸乙酯中很少结晶出来。(4)检验水杨酸(邻羟基苯甲酸)的方法是看是否含有酚羟基。即:取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若溶液呈紫色则含水杨酸,否则就不含有水杨酸。(5)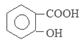 的相对分子质量为138,n(C7H6O3)=" 2.0" g÷138g/mol=0.0144mol;n(醋酸酐)=" (5.0" mL×1.08 g/cm3)÷102g/mol=0.0529mol.由于醋酸酐的物质的量大于水杨酸,所以得到的乙酰水杨酸应该按照水杨酸来计算。理论上得到乙酰水杨酸的质量为0.0144mol×180g/mol=2.6g.所以乙酰水杨酸的产率为(2.2g÷2.6g)×100%= 84.6%.
的相对分子质量为138,n(C7H6O3)=" 2.0" g÷138g/mol=0.0144mol;n(醋酸酐)=" (5.0" mL×1.08 g/cm3)÷102g/mol=0.0529mol.由于醋酸酐的物质的量大于水杨酸,所以得到的乙酰水杨酸应该按照水杨酸来计算。理论上得到乙酰水杨酸的质量为0.0144mol×180g/mol=2.6g.所以乙酰水杨酸的产率为(2.2g÷2.6g)×100%= 84.6%.
本题难度:一般
2、选择题 要将溴水中的溴提取出来,需要用到的一组仪器是
[? ]
A.普通漏斗、玻璃棒、烧杯
B.分液漏斗、玻璃棒、烧杯
C.大试管、试管夹、容量瓶
D.分液漏斗、烧杯、铁架台
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列有关除杂质(括号中为杂质)中,错误的是( )
A.福尔马林(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.溴乙烷(乙醇):多次加水振荡,分液,弃水层
C.苯(苯酚):加溴水,振荡,过滤除去沉淀
D.乙酸乙酯(乙酸):加氢氧化钠溶液,充分振荡,分液,弃水层
参考答案:A、甲酸是有机酸,能与碳酸钠反映生成二氧化碳和甲酸钠和水,福尔马林(甲醛溶液)中的溶质不与碳酸钠反应.甲醛易挥发,而盐类不挥发,所以用蒸馏法就能除杂,故A正确;
B、溴乙烷不溶于水,乙醇易溶于水,多次加水振荡,分液,弃水层可分开,故B正确;
C、苯中混有苯酚,加入溴水,溴易溶于有机溶剂苯,引进了新的杂质,应该加入NaOH后生成可溶于水的苯酚钠,然后用分液的方法分离,故C错误;
D、由于乙酸乙酯能够与氢氧化钠溶液反应,应该使用碳酸钠溶液,故D错误;
故选CD.
本题解析:
本题难度:一般
4、选择题 下列实验的设计可行的是( )
A.用澄清石灰水可区别Na2CO3和NaHCO3粉末
B.

用图装置进行浓硝酸与铜的反应制取并收集NO2
C.检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸
D.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、BaCl2、Na2CO3、HCl
参考答案:A、氢氧化钙和碳酸钠、碳酸氢钠溶液都生成白色沉淀,现象相同无法鉴别,可以用氯化钙溶液检验碳酸钠和碳酸氢钠,故A错误;
B、二氧化氮能和水反应生成硝酸和一氧化氮,所以二氧化氮不能用排水法收集,故B错误;
C、检验未知溶液是否含SO42ˉ可先加氯化钡,观察是否产生白色沉淀,再加稀盐酸排除碳酸钡和亚硫酸钡的干扰,故C正确;
D、为除去杂质离子又不引进杂质,除去食盐中的镁离子用氢氧化钠,除去钙离子用碳酸钠,除去硫酸根离子用氯化钡,除去过量的碳酸根离子用盐酸,然后蒸发结晶得到较纯净的食盐,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 现有三组混合液:(1)苯和水;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液.分离以上各混合液的正确方法依此是( )
A.分液、萃取、蒸馏
B.分液、蒸馏、萃取
C.萃取、蒸馏、分液
D.萃取、分液、蒸馏
参考答案:苯和水互不相溶,可用分液的方法分离;
乙醇和丁醇互溶,但二者沸点不同,可用蒸馏的方法分离;
溴化钠和单质溴的水溶液,可加入苯或四氯化碳,用萃取的方法分离,
故选B.
本题解析:
本题难度:一般