| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《化学平衡》答题技巧(2017年最新版)(二)
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是?,曲线II对应的实验条件改变是?。 参考答案:(1)>?(2)A?(3)33.3﹪? K=0.5?(4)升高温度?增大压强。 本题解析:(1)反应是从正反应方向开始的。由于在a点时反应还没有达到化学平衡,所以反应速率V(正)>V(逆) (2)反应是在体积固定的密闭容器中进行的,在反应的过程中物质的浓度越大,反应速率越快。由于在开始时反应物的浓度最大,所以在开始不久反应的速率最快。选项为A。(3)CO2(g)+3H2(g) 本题难度:一般 2、选择题 在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g) |
参考答案:B
本题解析:A、反应为前后气体体积相等的反应,混合气体的压强始终不变,所以不没有说明达到平衡,不选A;B、混合气体的密度等于混合气体的质量/容器的体积,若密度不变,容器的体积不变,说明混合气体的质量不变,即A物质的质量不变,说明反应达到平衡,选B;C、反应前后气体的物质的量不变,所以不能说明反应达到平衡,不选C;D、单位时间内生成C和消耗B都说明的是正反应速率,没有说明与逆反应速率的关系,不能说明反应达到平衡,不选D。
考点:平衡状态的标志。
本题难度:一般
3、选择题 (12分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H =-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
①能说明该反应已达平衡状态的是________
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1, 且保持不变
②下列措施中能使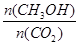 增大的是________ (选填编号)。
增大的是________ (选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=___________ , 若改变条件 (填选项),可使K=1。
A增大压强 B增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
参考答案:(1)①A ②CD ③0.20或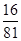 C (2)CH3OH-6e-+H2O=CO2+6H+
C (2)CH3OH-6e-+H2O=CO2+6H+
本题解析:
试题解析:(1)①未平衡时是个变量,现在不变说明已经达到平衡状态了,A.未平衡CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故A正确;容器的体积不变,气体质量是守恒的,则混合气体的密度始终不变,现在不随时间的变化而变化,不能说明已经达平衡状态,故B错误;单位时间内每消耗1.2mol H2,向正方向,同时生成0.4mol H2O,也向正方向,不能反映正逆反应之间的关系,故C错误;反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故C错误;②升高温度,平衡逆向移动,故比值减小,故A不选;恒温恒容下充入He(g),平衡不移动,故比值不变,故B不选;将H2O(g)从体系中分离,平衡正向移动,故比值变大,故选C;恒温恒容再充入2mol CO2和3mol H2,相当于增大压强,平衡正向移动,故比值变大,故选D;
③ CO2(g)+ 3H2(g)?CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
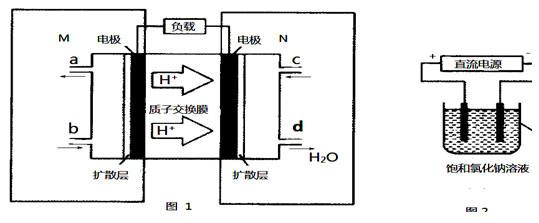
所以K=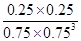 =0.20,而平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反量放热反应,降低温度,K值变大;(2)①M区是质子流出的一极,应是原电池的负极,发生氧化反应电极反应式为:CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+。
=0.20,而平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反量放热反应,降低温度,K值变大;(2)①M区是质子流出的一极,应是原电池的负极,发生氧化反应电极反应式为:CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+。
考点:化学平衡状态的判断;盖斯定律的应用;化学电源新型电池;化学平衡的影响因素
本题难度:困难
4、填空题 甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应反应来制备甲醇。
I:CH4(g)?+?H2O?(g)?=CO(g)?+?3H2(g)?△H?=+206.0?kJ/mol
II:CO?(g)?+?2H2?(g)?=?CH3OH?(g)?△H?=—129.0?kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH?(g)和H2(g)的热化学方程式为_______________。
(2)将1.0?mol?CH4和2.0?mol?H2O(g)通入容积为100?L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图 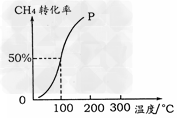
①假设100?℃时达到平衡所需的时间为5?min,则用H2表示该反应的平均反应速率为_____。
②100℃时反应I的平衡常数为__________。
(3)在压强为0.1?MPa、温度为300℃条件下,将a?mol?CO与 3a?mol?H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c?(H2)减少?
B.正反应速率加快,逆反应速率减慢?
C.CH3OH?的物质的量增加?
D.重新平衡c?(?H2)/?c(CH3OH?)减小? ?
E.平衡常数K增大
(4)工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是___________________。?
CO(g)+2H2(g),此反应能自发进行的原因是___________________。?
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为_________________; 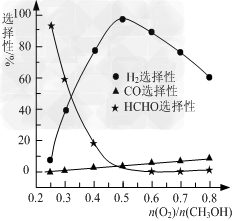
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
①?写出阳极电极反应式_______________。
②?写出除去甲醇的离子方程式_________________。 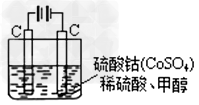
参考答案:(1)CH4(g)+H2O(g)=CH3OH?(g)+H2(g)?△H?=+77.0?kJ/mol
(2)①0.003?mol·L-1·min-1;②?2.25×10-4
(3)CD
(4)①该反应是一个熵增的反应?(△S>0);②2CH3OH+O2 2HCHO+2H2O
2HCHO+2H2O
(5)①?Co2+?-e-?=?Co3+;②?6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
本题解析:
本题难度:一般
5、填空题 碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。已知
①2CH4(g)+3O2(g)=2CO(g)+4H2O(1); △H1=-1214.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g); △H2=-566 kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(1)的△H=_______________。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是:____________________
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: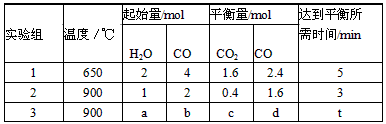
①实验1中,以v(H2)表示的平均反应速率为____________;
②该反应的正反应为_______(填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是
_____________(用含a、b的数学式表示)。
参考答案:(1)-890. 3 kJ/mol
(2)O2 +4e- +2H2O=4OH-
(3)①0.16mol/(L·min);②放;③a:b=1:2(或b=2a)
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《燃烧热》试.. | |