微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,在密闭恒压容器中,能表示反应X(g)+2Y(g)

?2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1:2:2;②Z的浓度不再发生变化;③容器中的压强不再发生变化;④单位时间内生成n?molZ,同时生成2n?molY;⑤容器中的气体平均相对分子质量不再发生变化;⑥容器中气体的密度不再发生变化.
A.①②
B.①③⑤
C.②⑤⑥
D.②③⑤
参考答案:①平衡时各物质的物质的量与反应初始物质的量及转化率有关,和化学方程式的系数无关,故①错误;
②反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,所以Z的浓度不再变化时,该反应达到平衡状态,故②正确;
③该反应是反应前后气体体积有变化的反应,但是该反应是在恒压条件下发生,所以容器中的压强不再发生变化,不能证明达到了平衡状态,故③错误;
④单位时间内生成nmolZ,反应是向右进行的,同时生成2nmolY,则反应向左进行,但是正逆反应速率是不相等的,故④错误;
⑤容器中的气体平均相对分子质量M=mn,反应前后混合气体的质量始终不变,该反应是一个反应前后物质的量变化的反应,所以当M不再发生变化时,表明已经平衡,故⑤正确;
⑥该容器的压强保持不变,所以容积变,根据质量守恒定律知,反应前后混合气体的质量始终不变,所以容器内气体的密度始终变,当容器中气体的密度不再发生变化时,表明达到化学平衡状态,故⑥正确.
故选C.
本题解析:
本题难度:一般
2、填空题 固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)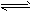 CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1某科学实验将6molCO2和8molH2充入
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1某科学实验将6molCO2和8molH2充入
2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。

(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________,最小的是__________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时氢气的转化率和该条件下反应的平衡常数K。(写出计算过程)
_____________________________________
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。
参考答案:(1)大于
(2)A;D
(3)解: CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始物质的量/mol 6 8 0 0
物质的量变化/mol 2 6 2 2
平衡物质的量/mol 4 2 2 2
H2的转化率= ×100%=
×100%= =75%
=75%

(4)升高温度;增大压强
本题解析:
本题难度:一般
3、填空题 (本题共12分)氨是一种重要的化工产品。“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
完成下列填空:
23.恒温恒容条件下,能说明该反应达到平衡状态的是 (填字母序号)。
a.ν(CO)消耗= ν(H2O)生成 b.c(CO2) = c(CO)
c.混合气体的总压不再改变 d.混合气体的密度不再改变
24.将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
|
| CO
| H2O
| CO2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 5
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
3
| 650
| 2
| 1
| A
| B
| t
|
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为 。
②A = 。
③平衡常数:K(900℃) K(650℃) (填“>”、“<”或“=”=)。
25.温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是 。
26.C、H、O、N元素中,核外电子占据5个不同轨道的原子,其最外层电子排布式是 。这四种元素形成的化合物 (填“一定是”、“一定不是”、“不一定是”)离子化合物。
27.能证明碳的非金属性比硅强的事实是 (选填编号)。
a.酸性:H2CO3强于H2SiO3 b.高温下SiO2与C生成Si和CO
c.键的极性:C-H > Si-H d.熔点:金刚石 > 单晶硅
参考答案:23、 a(2分) 24、 ①0.16mol/(L.min)(1分) ②A=0.8(1分) ③<(1分)
25、该反应使用催化剂,此温度是催化剂的活性温度;该反应吸热,升高温度有利于提高CO的转化率。(1分×2)(其他合理答案均给分)
26、2s22p3(1分)、 2s22p4 (1分); 不一定是(1分) 27、a、c(1分x2)
本题解析:23、在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.ν(CO)消耗= ν(H2O)生成表示正逆反应速率相等,a正确;b.c(CO2) = c(CO)并不能表示二者的浓度不再发生变化,因此不一定说明反应达到平衡状态,b错误;c.反应前后体积不变,因此压强始终不变,则混合气体的总压不再改变不能说明反应达到平衡状态,c错误;d.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度不再改变不能说明反应达到平衡状态,d错误,答案选a。
24、①根据表中数据可知实验1中从反应开始到达到平衡时生成CO21.6mol,则根据方程式可知生成氢气也是1.6mol,氢气浓度是0.8mol/L,所以以H2的浓度变化表示的反应速率为0.8mol/L÷5min=0.16mol/(L.min)。
②根据实验1中数据可知平衡时CO、水蒸气、CO2和氢气的平衡浓度分别是1.2mol/L、0.2mol/L、0.8mol/L、0.8mol/L,所以该温度下平衡常数K=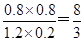 。设实验3中A=x,则平衡时CO、水蒸气、CO2和氢气的平衡浓度分别是(1-0.5x)mol/L、(0.5-0.5x)mol/L、0.5xmol/L、0.5xmol/L,所以
。设实验3中A=x,则平衡时CO、水蒸气、CO2和氢气的平衡浓度分别是(1-0.5x)mol/L、(0.5-0.5x)mol/L、0.5xmol/L、0.5xmol/L,所以 ,解得x=0.8。
,解得x=0.8。
③根据实验2中数据可知平衡时CO2的物质的量是0.4mol,与实验3相比这说明升高温度CO2的物质的量减小,即升高温度平衡向逆反应方向进行,所以900℃时的平衡常数小于650℃时平衡常数。
25、由于该反应需要使用催化剂,此温度是催化剂的活性温度;另外生成CO的反应是吸热反应,升高温度有利于提高CO的转化率,所以实际生产过程中将温度控制在400℃左右。
26、C、H、O、N元素中,核外电子占据5个不同轨道的原子是N和O,根据核外电子排布规律可知其最外层电子排布式分别是2s22p3、 2s22p4。这四种元素形成的化合物不一定是离子化合物,例如尿素(NH2)2CO等。
27、a.非金属性越强,最高价氧化物水化物的酸性越强,则酸性H2CO3强于H2SiO3可以说明碳的非金属性比硅强,a正确;b.高温下SiO2与C生成Si和CO属于难挥发性物质制备易挥发性,与非金属性强弱无关系,b错误;c.非金属性越强,与H盐酸形成的共价键极性越强,则键的极性C-H > Si-H可以说明碳的非金属性比硅强,,c正确;d.非金属性强弱与其单质的熔点高低无关系,d错误,答案选ac。
考点:考查平衡状态判断、计算、外界条件对平衡状态的影响、核外电子排布以及非金属性强弱比较
本题难度:困难
4、填空题 (15分)甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下,发生如下反应制得: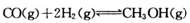 。请根据图示回答下列问题:
。请根据图示回答下列问题:

(1) 从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________。
(2) 写出该反应的热化学方程式________________
(3) 恒容条件下,下列措施中能使 增大的有________________
增大的有________________
A升高温度 B充人He气
C再充入1molCO和2mol H 2 D使用催化剂
(4) 若在温度和容器相同的三个密闭容器中,按不同方式投人反应物.,测得反应达到平衡
参考答案:
本题解析:
本题难度:简单
5、选择题 将1?mol?H2(g)和2?mol?I2(g)置于某2?L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?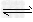 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间变化的曲线如曲线Ⅱ所示.若改变反应条件,φ(HI)的变化曲线如曲线Ⅰ所示,则改变的条件可能是
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间变化的曲线如曲线Ⅱ所示.若改变反应条件,φ(HI)的变化曲线如曲线Ⅰ所示,则改变的条件可能是
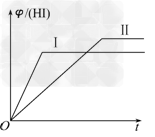
[? ]
A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
参考答案:C
本题解析:
本题难度:一般