| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《物质的量》考点特训(2017年冲刺版)(十)
参考答案:C 本题解析:A错,2 g C-13含有的原子数小于NA个;B错,46g NO2和46g N2O4含有的原子数均为3NA;C正确;D错,乙醇在标准状况下不是气体; 本题难度:一般 3、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是 |
参考答案:A
本题解析:A、锌和氮原子之间有4个σ键,每个氨气中有三个σ键,所以总共有4+3*4=16根σ键,正确,选A;B、电解精炼时阳极先溶解锌铁等活泼金属,所以当有1摩尔电子转移时阳极溶液的铜肯定比0.5摩尔少,不选B;C、淀粉和葡萄糖的相对分子质量不同,最简式也不同,所以不能计算混合物中碳原子数,不选C;D、60克石英含有1摩尔二氧化硅,含有4摩尔硅氧键,所以不选D。
考点:化学键类型,电解原理的应用,原子晶体的结构
本题难度:一般
4、计算题 硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+ ),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将 (填“偏高”、或“偏低”或“不变”)。
(2)氨气常用 检验,现象是 。
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
参考答案:
(1)偏高 (2)湿润的红色石蕊试纸 试纸颜色由红变蓝
(3)n(Ni2+)=" 0." 04000 mol·L-1×31. 25 mL×10-3L·mL-1 ="1." 250×10-3 mol
n(NH4 +)= 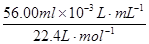 ="2." 500×10-3 mol
="2." 500×10-3 mol
n(SO42-)= 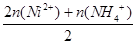 =
=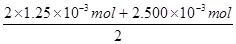 ="2." 500×10-3mol
="2." 500×10-3mol
m(Ni2+)=" 59" g·mol-1×1. 250×10-3 mol="0." 07375 g
m(NH4+)=" 18" g·mol-1×2. 500×10-3 mol="0." 04500 g
m(SO42-)=" 96" g·mol-1×2. 500×10-3 mol="0." 2400 g
n(H2O)=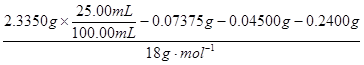 ="1." 250×10-2 mol
="1." 250×10-2 mol
x :y :m:n= n(NH4+):n(Ni2+):n(SO42-):n(H2O)=" 2:1:2:10"
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O
本题解析:本题为一道定量分析的计算题,首先要弄清楚计算什么,怎么计算。
(1)Ni2+含量的测定是通过EDTA滴定法来测定的。要找到误差分析的依据,该滴定法类似于酸碱滴定方法。若滴定前,滴定管未用EDTA标准液润洗,则EDTA标准液的浓度就会偏低,则滴定消耗的EDTA标准液的体积就会偏高,测得的Ni2+含量就会偏高。
(2)氨气的检验有两种常用的方法:①浓盐酸,具体是用玻璃棒蘸取浓盐酸,靠近待测气体,若产生白烟,则为氨气。②试纸法。有两种常用的试纸,一种是湿润的酚酞试纸,湿润的酚酞试纸变红;另一种是湿润的紫色(或红色)石蕊试纸,试纸变蓝。
(3)实验①用EDTA滴定Ni2+由此可以计算出原100mL溶液,即2.3350g样品含Ni2+ 为
n(Ni2+)=0.04000×31.25×10-3×4=0.005mol
实验②发生的反应为:NH4++OH-=NH3 ↑+H2O可得出原2.3350g样品含NH4+为
N(NH4+)=n(NH3)=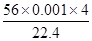 =0.01mol
=0.01mol
又根据电荷守恒:n(Ni2+)×2 + n(NH4+)×1= n(SO42-)×2
即原2.3350g样品含SO42-为n(SO42-)=0.01mol
综上可以得出上述三种离子的质量,m(Ni2+)=0.005×59=0.295g
M(NH4+)=0.01×18=0.18g m(SO42-)=0.01×98=0.98g
则H2O的质量m(H2O)=2.3350-0.295-0.18-0.98=0.9g n(H2O)=0.05mol
x:y:m:n=n(NH4+):n(Ni2+):n(SO42-):n(H2O)="0.01" :0.005 :0.01 :0.05="2" :1 :2:10
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O
【考点定位】本题考查定量分析实验中常见滴定法的理解应用能力、知识的迁移能力和基本的计算能力。难度中档偏上。
本题难度:一般
5、简答题 在标准状况下将448mL的氯化氢溶于水,配制成250mL溶液
(1)求所得盐酸的物质的量浓度?
(2)若该盐酸的密度为ag/mL,则该盐酸的氯化氢溶质质量分数为多少?
参考答案:(1)448mL的氯化氢的物质的量为0.448L22.4L/mol=0.02mol,该盐酸的物质的量浓度为0.02mol0.25L=0.08mol/L,
答:该盐酸的物质的量浓度为0.08mol/L;
(2)根据c=1000ρωM可知,该盐酸中HCl的质量分数为0.08×36.51000a=2.921000a,
答:该盐酸的氯化氢溶质质量分数为2.921000a.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《铝》试题强.. | |