微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列解释实验现象的反应方程式不正确的是
A.新制氯水中滴加NaOH溶液后,黄绿色褪去Cl2+2OH-=Cl-+ClO-+H2O
B.向NaHCO3?溶液中滴加酚酞溶液,溶液变红HCO3-?H++CO32-
C.向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀3Mg(OH)2+2Fe3+=2Fe(OH)3↓+3Mg2+
D.向少量苯酚稀溶液中逐滴加入饱和溴水,生成白色沉淀
参考答案:B
本题解析:分析:A、新制氯水中滴加NaOH溶液后,氯气和氢氧化钠溶液反应生成氯化钠次氯酸钠和水;
B、碳酸氢根离子水解显碱性;
C、氯化铁水解显酸性能溶解氢氧化镁,促进铁离子水解,生成氢氧化铁沉淀;
D、苯酚和浓溴水发生取代反应反应生成白色沉淀;
解答:A、新制氯水中滴加NaOH溶液后,黄绿色褪去,是氯气和氢氧化钠反应,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;故A正确;
B、向NaHCO3 溶液中滴加酚酞溶液,溶液变红是因为碳酸氢根离子水解显碱性,反应的离子方程式为:H2O+HCO3-?OH-+H2CO3 ;故B错误;
C、向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀,反应的离子方程式为:3Mg(OH)2+2Fe3+=2Fe(OH)3↓+3Mg2+;故C正确;
D、向少量苯酚稀溶液中逐滴加入饱和溴水,生成白色沉淀,反应的化学方程式为; 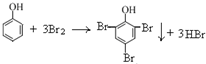 ,故D正确;
,故D正确;
故选B.
点评:本题考查了反应离子方程式的正误分析,书写方法,掌握反应实质是解题关键,题目难度中等.
本题难度:简单
2、选择题 关于强、弱电解质的叙述不正确的是
[? ]
A、强电解质在溶液中完全电离,不存在电离平衡
B、导电能力强的溶液其电解质是强电解质
C、同一弱电解质的溶液,当温度不同时,其导电能力也不相同
D、强电解质在液态时,有的导电,有的不导电
参考答案:B
本题解析:
本题难度:简单
3、填空题 在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH 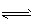 CH3COO-+H+ ; △H>0
CH3COO-+H+ ; △H>0
(1)下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是____。
a.加入少量0. 10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0. 010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0. 10 mol·L-1的NaOH溶液
(2)25℃时,该电离平衡的平衡常数为1.75×10-5。现有:
①0. 10 mol·L-1 CH3COOH溶液②0.001 0 mol·L-1 CH3COOH溶液
其c(H+)之比为①:②=____。[提示:进行简化计算,平衡时的 c(CH3COOH)可用起始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
(3)25℃时,向0.10 mol·L-1 CH3COOH溶液中加入一定量固体CH3 COONa (假设溶液体积不变),若溶液中c(CH3COO-)为1.0 mol·L-1,则溶液中 c( H+)=____mol·L-1(计算结果保留小数点后两位有效数字)。溶液中各种离子浓度关系是___。
参考答案:(1)bcf
(2)10 : 1
(3)1. 75×10-6 ;c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
本题解析:
本题难度:一般
4、选择题 下列物质分类正确的是(?)
A.Cu(OH)2难溶于水,属于非电解质
B.SO2能与碱反应生成盐和水,属于酸性氧化物
C.NH4Cl组成中不含金属离子,不属于盐
D.金属铝易导电,属于电解质并且属于强电解质
参考答案:B
本题解析:A电解质是在水溶液里或熔融状态下能导电的化合物,非电解质是在水溶液里和熔融状态下都不能导电的化合物。Cu(OH)2尽管难溶于水,但它在熔融状态下能导电,是电解质。错误。B SO2符合酸性氧化物的定义,正确。C尽管在氯化铵中无金属阳离子,但铵根离子性质类似金属阳离子,故铵盐属于盐,错误。D 电解质是化合物,金属铝尽管能导电,但它是单质,错误。
本题难度:一般
5、选择题 在NH4Cl溶液中各离子浓度大小排序正确的是( )
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)>c(OH-)>cCH+)
C.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
参考答案:NH4Cl溶液中,铵根离子水解,则c(Cl-)>c(NH4+),
水解显酸性,则c(H+)>c(OH-),
显性离子大于隐性离子,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故选C.
本题解析:
本题难度:简单