微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如下图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)  2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是(?)
2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是(?)

A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y
B.若x∶y=1∶2,则平衡时,M中的转化率:A>B
C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90%
D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v正<v逆
参考答案:A
本题解析:A项, A(g) + 3B(g)  2C(g)
2C(g)
起始/mol? x? y? 0
M平衡/mol? x-a? y-3a? 2a
N平衡/mol? x-b? y-3b? 2b
若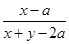 =
=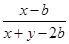 ,则x=y,正确。
,则x=y,正确。
B项,M中转化率:
α(A)=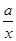 ×100%
×100%
α(B)=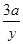 ×100%
×100%
若x∶y=1∶2则
α(A)=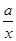 ×100% α(B)=
×100% α(B)=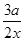 ×100%
×100%
α(A)<α(B),错误。
C项,A(g)+3B(g)  2C(g) Q
2C(g) Q
1 mol?192 kJ
m?172.8 kJ
m=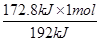 =0.9 mol
=0.9 mol
由于x的值不确定,所以A的转化率不确定,错误。
D项, A(g) + 3B(g)?2C(g)
起始/mol? 1.2? 1? 0
平衡/mol? 1.0? 0.4? 0.4
K=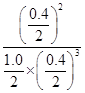 =10
=10
Qc=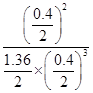 =
=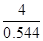
K>Qc,所以v正>v逆,错误。
本题难度:一般
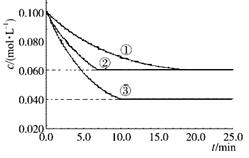
2、填空题 在溶液中,反应A +2B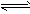 C分别在三种不同实验条件下进行,它们的起始浓度均为c( A)=0.100 mol/L、c(B) =0.200 mol/L及c(C) =0 mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c( A)=0.100 mol/L、c(B) =0.200 mol/L及c(C) =0 mol/L。反应物A的浓度随时间的变化如下图所示。
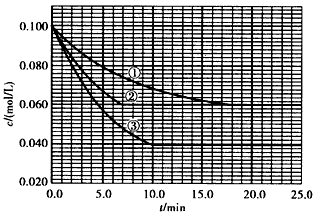
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_________________________________________________;
③_________________________________________________;
(2)实验②平衡时B的转化率为________ ;实验③平衡时C的浓度为________;
(3)该反应的△H_____ 0,其判断理由是_______
(4)该反应进行到4.0 min时的平均反应速率:
实验②:VB=____________,
实验③:VC=____________。
参考答案:(1)加催化剂,达到平衡的时间缩短,平衡时A的浓度未变;温度升高,达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0. 4);0.060 mol/L
(3)> ;温度升高,平衡向正反应方向移动,故该反应是吸热反应
(4)0.014mol/(L·min);0.008mol/(L·min);
本题解析:
本题难度:一般
3、选择题 在密闭容器中,反应A(g)+2B(g) C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是
C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是
A.若反应①、②的平衡常数分别为K1、K2则K1<K2
B.反应A(g)+2B(g)  C(g)的ΔH >0?
C(g)的ΔH >0?
C.实验②平衡时B的转化率为60%?
D.减小反应③的压强,可以使平衡时c(A)="0.060" mol·L-1
参考答案:B
本题解析:反应①、②起始和平衡时c(A)均相同,达到平衡需要的时间②比①短,说明②中使用了催化剂,K相等,A错误;
反应①或②:
A(g)+2B(g) C(g)
C(g)
起始(mol/L)? 0.1? 0.2
平衡(mol/L)? 0.06? 0.12? 0.04
K=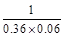 。
。
反应③:
A(g)+2B(g) C(g)
C(g)
起始(mol/L)? 0.1? 0.2
平衡(mol/L)? 0.04? 0.08? 0.06
K=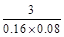 。
。
反应③比反应①平衡常数大而且反应速率快,所以反应③比反应①温度高,正反应是吸热反应,B正确;
实验②平衡时B的转化率为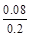 ×100%=40%,C错误;
×100%=40%,C错误;
减小反应③的压强,平衡向左移动,若使c(A)="0.060" mol·L-1则与①是等效平衡,但①、③温度不同,不可能是等效平衡,D错误。
点评:平衡常数只与温度有关。
本题难度:一般
4、选择题 在一密闭容器中进行如下反应:2SO2(气)+O2(气)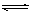 2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
A.SO2为0.4mol/L、O2为0.2mol/L
B.SO3为0.4mol/L
C.SO2、S03均为0.15mol/L
D.SO2为0.25mol/L
参考答案:D
本题解析:可逆反应的特点是不可能进行到底。即反应物不可能完全转化为生成物,生成物也不可能完全转化为反应物。A若SO2为0.4mol/L则SO3为0 mol/L。错误。B SO3为0.4mol/L则SO2为0mol/L,错误。C 若SO2、S03均为0.15mol/L ,则硫原子不符合质量守恒定律,错误。D若SO2为0.25mol/L,则O2为0.125mol/L。SO3为0.15m mol/L。符合可逆反应的特点,正确。
本题难度:一般
5、选择题 可逆反应mA(g)+nB pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率都增大
参考答案:A
本题解析:A.若增加B的量,平衡体系颜色加深,由于A和C都是无色气体,说明平衡发生了移动,只有B是气体时改变其物质的量才会使平衡发生移动。因此B必是气体。正确。B.增大压强,平衡不移动,若B、D是非气态物质,则说明m=p,若B、D中两种物质是气态,m+n=p+q;若B、D中只有一种物质为气态,则反应物的气体的物质的量的和与生成物中气态物质的物质的量的和相等。因此该选项错误。C.若升高温度,A的转化率减小,酸根温度,平衡逆向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应为吸热反应,所以正反应是放热反应。错误。D.若B是气体,增大A的量, B的转化率增大,但是A的转化率反而降低。错误。
本题难度:一般