微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定量的密闭容器中进行反应: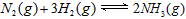 。已知反应过程中某一时刻
。已知反应过程中某一时刻
 的浓度分别为0.1mol/L.0.3mol/L.0.2mol/L。当反应达到平衡时,可能存在的数据是
的浓度分别为0.1mol/L.0.3mol/L.0.2mol/L。当反应达到平衡时,可能存在的数据是
[? ]
A.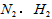 均为0.18mol/L
均为0.18mol/L
B.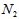 为0.15mol/L
为0.15mol/L
C.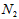 为0.2mol/L,
为0.2mol/L,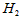 为0.6mol/L
为0.6mol/L
D.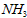 为0.4mol/L
为0.4mol/L
参考答案:B
本题解析:
本题难度:一般
2、选择题 在两个恒容容器中有平衡体系:A(g) 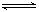 2B(g)和2C(g)
2B(g)和2C(g) 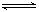 D(g),X1和X2分别是A和C的转化率。在温度不变时分别增加相同物质的量的A和C。下列判断正确的是(?)
D(g),X1和X2分别是A和C的转化率。在温度不变时分别增加相同物质的量的A和C。下列判断正确的是(?)
A.X1降低,X2增大? B.X1、X2均降低? C.X1增大,X2降低? D.X1、X2均增大
参考答案:A
本题解析:由于反应物和生成物都是一种,因此增加反应物的物质的量,都相当于是增大压强,前者向逆反应方向移动,后者向正反应方向移动,所以答案选A。
本题难度:一般
3、选择题 在A(g)+ pB(g) qC(g)的反应中,经t秒后C的浓度增加m mol/L,则用B浓度的变化来表示的反应速率是
qC(g)的反应中,经t秒后C的浓度增加m mol/L,则用B浓度的变化来表示的反应速率是
[? ]
A.pq/mt mol·L-1·s-1
B.mt/pq mol·L-1·s-1
C.pm/qt mol·L-1·s-1
D.pt/mq mol·L-1·s-1
参考答案:C
本题解析:
本题难度:简单
4、填空题
[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
蓝色?黄色
试回答下列问题:
(1)欲使溶液由黄色变为蓝色,可采取的两种方法为:①?;②?。
(2)欲使溶液由蓝色变为绿色,可采取的两种方法为:①?;②?。
参考答案:(1)加水?加 AgNO3(s)[或 AgNO3(aq)]
(2)加 CuCl2(s)[或浓 CuCl2(aq)]?加NaCl(s)[或浓 NaCl(aq)等]
本题解析:(1)加入 Ag+降低 Cl-浓度,可使平衡向左移动。
将水虚拟为容器,将离子虚拟为气体,则加“水——容器”容积扩大,平衡向气体体积扩大的方向,即本反应的逆反应方向移动。
(2)由美学知识可知,蓝黄相混可得绿色。这样,平衡向右移动,可使溶液由蓝变绿。由(1)知,加水 CuCl2浓度降低,平衡向左移动;则增大 CuCl2的浓度(或 Cu2+的浓度,或 Cl-的浓度)平衡向右移动。
本题难度:一般
5、选择题 下列叙述中可以说明反应2HI(g)  H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成n mol H2的同时生成n mol HI?②一个H—H键断裂的同时有两个H—I键断裂?③百分组成HI%=I2%?④反应速率v(H2)=v(I2)=1/2v(HI)?⑤[HI]∶[H2]∶[I2]=2∶1∶1?⑥v(HI)分解=v(HI)生成?⑦压强不变
A.①③⑤
B.②⑥
C.④⑤
D.④⑥⑦
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项⑥可以说明。①中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不能说明。②中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,可以说明。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,③⑤不能说明。速率之比是相应的化学计量数之比,因此④中的关系始终是成立,不能说明。根据反应的方程式可知,反应前后体积是不变的,因此压强始终是不变的,所以⑦不能说明,因此答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:简单