微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.0.1mol·L-1NaHCO3溶液中的粒子浓度:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.将标况下2.24L的CO2通入150mL 1mol·L-1NaOH溶液中充分反应后的溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+2c(A-)=c(H+)+2c(HA)
参考答案:B
本题解析:A、碳酸氢钠溶液中存在碳酸氢根离子的电离和水解,水解程度大于其电离程度,所以溶液层碱性,则不水解的离子钠离子的浓度最大,其次为碳酸氢根离子,然后是水解产生的氢氧根离子,所以粒子的浓度关系是c(Na+)>c(HCO3-)> c(OH-)>c(H2CO3)> c(H+) >c(CO32-),错误;B、标准状况下2.24L二氧化碳的物质的量是0.1mol,与0.15molNaOH反应,则Na元素的物质的量浓度与C元素的物质的量浓度之比是0.15:0.1=3:2,根据物料守恒,则2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),正确;C、pH=3的二元弱酸中氢离子浓度与氢氧化钠溶液混合后溶液pH=7,为中性,则c(OH-)=c(H+),根据电荷守恒,则c(OH-)+2c(R2-)+c(HR-)=c(H+)+ c(Na+),所以2c(R2-)+c(HR-)=c(Na+),错误;D、0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后,得到的溶液为等浓度的HA和NaA的混合液,溶液pH>7,说明混合液为碱性,A-的水解程度大于HA的电离程度,根据物料守恒,则2c(Na+)= c(A-)+ c(HA),根据电荷守恒,有c(OH-)+c(A-)=c(H+)+c(Na+),两式联立,消去c(Na+),可得2c(OH-)+c(A-)=2c(H+)+c(HA),错误,答案选B。
考点:考查电解质溶液中离子浓度的比较,守恒规律的应用
本题难度:困难
2、选择题 下列离子方程式中,属于水解反应的是
[? ]
A.HCOOH+H2O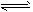 HCOO-+ H3O+
HCOO-+ H3O+
B.CO2+H2O HCO3-+ H+
HCO3-+ H+
C.CO32-+H2O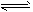 HCO3-+OH-
HCO3-+OH-
D.HS-+H2O S2-+H3O+
S2-+H3O+
参考答案:C
本题解析:
本题难度:简单
3、填空题 常温下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列顺序为 (填序号);
(2)实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是浑浊的溶液,产生浑浊的原因是(用离子方程式表示)
(3)物质的量浓度相同的①氨水②氯化铵③碳酸氢铵④硫酸氢铵⑤硫酸铵
在上述五种溶液中,铵根离子物质的量浓度由大到小的顺序是
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、39l kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
参考答案:(1)①②⑤⑥③④ (2)Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
(3)⑤>④>②>③>① (4)N2(g)+3H2(g) 2NH3(g)
2NH3(g) 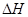 =-92.0kJ/mol
=-92.0kJ/mol
本题解析:(1)盐酸是一元强酸,醋酸是一元弱酸,醋酸钠是弱酸强碱盐,氢氧化钠是一元强碱。氯化铁是强酸弱碱盐,氯化钠是强酸强碱盐,所以在浓度相等的条件下,pH由小到大排列顺序为①②⑤⑥③④。
(2)氯化铁溶于水,铁离子水解生成氢氧化铁和盐酸,所以加入盐酸的目的是抑制铁离子的水解,方程式是Fe3++3H2O Fe(OH)3+3H+。
Fe(OH)3+3H+。
(3)在溶液中NH4+水解,而硫酸氢铵能电离出氢离子,抑制NH4+水解。HCO3-水解,显碱性,促进NH4+水解,所以五种溶液中,铵根离子物质的量浓度由大到小的顺序是⑤>④>②>③>①。
(4)反应热是断键吸收的能量和形成化学键所放出的能量的差值,则该反应的反应热△H=3×436kJ/mol+946kJ/mol-2×3×391kJ/mol=-92.0kJ/mol,所以反应的热化学方程式是N2(g)+3H2(g) 2NH3(g)
2NH3(g) 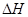 =-92.0kJ/mol。
=-92.0kJ/mol。
考点:考查pH的判断、盐类水解的应用、溶液中离子浓度比较以及反应热的计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,差值对学生灵活运用基础知识解决实际问题的能量的培养。旨在提高学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:困难
4、选择题 下列水解离子方程式正确的是:
A.CO32-+H2O CO2 +2OH-
CO2 +2OH-
B.I-+H2O HI+OH-
HI+OH-
C.SO32-+2H2O H2SO3+2OH-
H2SO3+2OH-
D.HPO42- +H2O H2PO4- +OH-
H2PO4- +OH-