| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《与量有关的离子方程式的书写》试题强化练习(2017年最新版)(十)
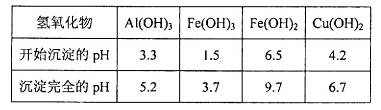 由上表可知:当溶液pH=4时,可以完全除去的离子是______,不能完全除去的离子是________。 (4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到 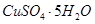 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下, 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,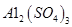 饱和溶液中 饱和溶液中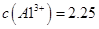 mol mol ______________。 ______________。(5)若要测定硫酸铜晶体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙、_________________。实验过程中硫酸铜晶体加热失水后在空中冷却后称量,则测定结果______________(填“偏高”、? “偏低”或“不变”)。? 参考答案: 本题解析:(1)根据原子守恒可知缺H4SiO4,孔雀石酸溶后有Fe2+,双氧水有强氧化性,发生氧化还原反应: 2Fe2++H2O2+2H+= 2Fe3++2H2O;(2)调节pH=4的目的是沉淀Fe3+,最后得到硫酸铜晶体,为不引入杂质,选择B;(3)结合表中所给数据分析;(4)该同学的观点是错误的,通过计算可知,滤液B中C(Al3+)=3.2×10-4 mol?L-1,浓缩后C(Al3+)=6.4×10-4 mol?L-1《2.25 mol?L-1,所以不会有硫酸铝晶体洗出;(5)坩埚,硫酸铜在空气中中冷却后吸收了部分水,导致质量增大,测得结晶水含量偏低。 本题难度:困难 3、选择题 下列反应的化学方程式(或离子方程式)错误的是( ) B.酯的水解反应?CH3CH2OOCCH3+H218O C.苯酚与氢氧化钠溶液反应?C6H5OH+OH-→C6H5O-+H2O D.醋酸溶解水垢(主要成分是碳酸钙)CO32-+CH3COOH→CO2↑+CH3COO-+H2O 参考答案:A、乙醛与银氨溶液反应化学方程式为:CH3CHO+2[Ag(NH3)2]OH △ 本题解析: 本题难度:简单 4、选择题 下列离子方程式正确的是 (?) 参考答案:C 本题解析:略 本题难度:一般 5、简答题 25℃,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液.回答下列问题: 参考答案:(1)存在水的电离平衡、醋酸的电离平衡、醋酸根离子的水解平衡,分别为H2O?H++OH-、CH3COOH?CH3COO-+H+、CH3COO-+H2O?CH3COOH+OH-, 本题解析: 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《物质的分离.. | |