| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《盐类水解的原理》考点强化练习(2017年押题版)(十)
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙  丙。则: 丙。则:①写出上述反应的化学方程式 。 ②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为 ③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为 。 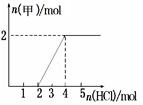 参考答案:Ⅰ.①FeCl3+3H2O 本题解析:Ⅰ.①甲为三价金属氯化物,常见的只有铝和铁,又因为生成的氯化物为红棕色粉末,所以甲一定为FeCl3,则甲发生a反应的化学方程式为:FeCl3+3H2O 本题难度:困难 2、选择题 对滴有酚酞试液的下列溶液,操作后颜色变深的是 |
参考答案:B
本题解析:明矾中Al3+水解显酸性,既使加热也不能使酚酞变红,A错;CH3COO-水解显碱性,加热促进水解,酚酞的颜色加深,B正确;NH4+抑制氨水中一水合氨的电离,酚酞的颜色变浅,C错;小苏打溶液中加入NaCl,不影响HCO3-的水解和电离,酚酞的颜色不变化,D错。答案选B。
本题难度:一般
3、选择题 下列说法不正确的是
A.0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-)
B.在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+) ="c(OH" -)+2c(CO32-)+c(HCO3-)
C.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡
D.常温常压下能自发进行的反应,一定都是放热反应
参考答案:D
本题解析:硫酸铵化学式为(NH4)2SO4,属于强酸弱碱盐,水溶液呈酸性,所以A正确;根据电荷守恒原理可知,溶液中阴离子带的负电荷总数应该等于阳离子带的正电荷,故B正确;Na2CO3属于强碱弱酸盐,水溶液呈碱性,所以滴有酚酞的溶液变红,当加入氯化钡溶液后,生成碳酸钡沉淀和氯化钠溶液,呈中性,故C正确;能否自发进行,除了和焓变有关,与熵变也有关,它们共同决定,故D错误。
考点:考查电离平衡相关知识
本题难度:一般
4、填空题 (17分)铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯: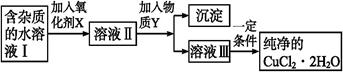
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
参考答案:(1)将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离;(2分)(2)C(2分)
(3)CuO[Cu(OH)2、CuCO3、Cu2(OH)2CO3也可以](2分)
(4)不能 加碱使Fe3+沉淀的同时也能使Cu2+沉淀(2分)
(5)不能 应在HCl或SOCl2等混合液气流中加热蒸发结晶(2分)
(6)碳酸钙溶解,产生气泡和红褐色沉淀(3分)
本题解析:(1)Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开,根据题干提供信息可知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去,故答案为:将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离;(2)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,故答案为:C;(3)结合题示,调节pH3.2~4.7,使Fe3+全部沉淀,同样不引进新杂质,所以Y最好为CuO或Cu(OH)2或CuCO3,故答案为:CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3;(4)如果直接加入碱,会使使Fe3+沉淀的同时也能使Cu2+沉淀,二者不能分离。(5)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),所以应在HCl或SOCl2等混合液气氛中采用加热蒸发结晶的方法,以得到CuCl2?2H2O的晶体,故答案为:不能;应在HCl或SOCl2等混合液气流中加热蒸发结晶.(6)溶液显酸性,加入碳酸钙,酸与碳酸钙反应产生二氧化碳气体,同时溶液的pH升高,产生氢氧化铁红褐色沉淀。
考点:难溶电解质的溶解平衡,物质的分离,盐类水解的应用。
本题难度:一般
5、选择题 在盐类水解的过程中,下列说法正确的是( ? )
A.盐的电离平衡被破坏
B.水的电离程度一定会增大
C.溶液的pH一定会增大
D.(H+)与c(OH-)的乘积一定会增大
参考答案:B
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《硫及其化合.. | |