| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《盐类水解的原理》考点强化练习(2017年押题版)(六)
参考答案:C 本题解析:A.盐酸易挥发,将 0.1 mol·L-1HCl溶液加热到100℃,盐酸因挥发c(H+)降低,溶液的pH减小,A项错误;B.将pH=4的醋酸溶液加水稀释后,酸性减弱,c(H+)降低,由于c(H+)·c(OH-)=KwW的乘积不变,溶液中c(OH-)升高,B项错误;C.常温下,若1mLpH=1的盐酸n(H+)=0.0001mol,与10mLNaOH溶液混合后溶液的pH=7,说明酸碱恰好反应,NaOH的物质的量为0.0001mol,则c(NaOH)=0.01mol/L,NaOH溶液的pH=12,C项正确;D.酚酞的变色范围是8-10,PH小于8,呈现无色,在滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,此时溶液可能显中性,D项错误;选C。 本题难度:一般 2、填空题 (12分,每空2分)(1)常温下,将0.2 mol/L HCl溶液与0.2 mol/L氨水等体积混合(忽略混合后溶液体积的变化),测得混合后溶液的pH=6,试回答以下问题: |
 Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。
Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。 参考答案:(1)①NH4+ + H2O  NH3·H2O + H+ (2)10-6mol/L (3)C
NH3·H2O + H+ (2)10-6mol/L (3)C
(4)③> ②>① (5)氧化铁(6)5
本题解析:)常温下,将0.2 mol/L HCl溶液与0.2 mol/L氨水等体积混合,两者恰好完全反应生成NH4Cl,NH4Cl在水中完全电离产生:NH4+、Cl-,NH4+会水解:NH4+ + H2O  NH3·H2O + H+,使溶液中c(H+)>c(OH-),溶液呈酸性;水解促进了水的电离,则水电离出的c(OH-)= c(H+)=10-6mol/L;常温下,将0.2 mol·L-1的盐酸与 0.2mol·L-1的氨水混合,若所得的混合溶液中的pH=7,可知溶液为NH4Cl和少量NH3·H2O的混合液,主体离子为NH4+、Cl-,次要微弱离子为H+、OH-,且存在电荷守恒:c(NH4+)+ c(H+)= c(Cl-)+ c(OH-),溶液呈中性即c(OH-)= c(H+),则c(NH4+)= c(Cl-),故C项正确;因为酸性强弱:CH3COOH>H2CO3>HCO3-,则水解程度大小关系为:CO32—> HCO3-> CH3COO—,故①CH3COONa ② NaHCO3 ③Na2CO3的碱性强弱为:③> ② >①;氯化铁溶液中存在水解平衡:FeCl3+3H2O
NH3·H2O + H+,使溶液中c(H+)>c(OH-),溶液呈酸性;水解促进了水的电离,则水电离出的c(OH-)= c(H+)=10-6mol/L;常温下,将0.2 mol·L-1的盐酸与 0.2mol·L-1的氨水混合,若所得的混合溶液中的pH=7,可知溶液为NH4Cl和少量NH3·H2O的混合液,主体离子为NH4+、Cl-,次要微弱离子为H+、OH-,且存在电荷守恒:c(NH4+)+ c(H+)= c(Cl-)+ c(OH-),溶液呈中性即c(OH-)= c(H+),则c(NH4+)= c(Cl-),故C项正确;因为酸性强弱:CH3COOH>H2CO3>HCO3-,则水解程度大小关系为:CO32—> HCO3-> CH3COO—,故①CH3COONa ② NaHCO3 ③Na2CO3的碱性强弱为:③> ② >①;氯化铁溶液中存在水解平衡:FeCl3+3H2O Fe(OH)3+3HCl,加热水解平衡正向移动,且HCl挥发,故将氯化铁溶液蒸干则生成Fe(OH)3,灼烧2Fe(OH)3==Fe2O3+3H2O,故最后得到的固体是Fe2O3;在常温下Ksp(Cu(OH)2)=2×10-20可知向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,得:
Fe(OH)3+3HCl,加热水解平衡正向移动,且HCl挥发,故将氯化铁溶液蒸干则生成Fe(OH)3,灼烧2Fe(OH)3==Fe2O3+3H2O,故最后得到的固体是Fe2O3;在常温下Ksp(Cu(OH)2)=2×10-20可知向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,得: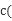 O
O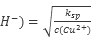 =10-9 mol/L,则溶液pH=5。
=10-9 mol/L,则溶液pH=5。
考点:弱电解质电离、水解平衡、难溶电解质溶解平衡。
本题难度:困难
3、选择题 下列说法错误的是
A.0.1 mol·L-1的CH3COOH溶液中,由水电离的c(H+)为10-13 mol·L-1
B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1
参考答案:
本题解析:
本题难度:简单
4、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1 mol/L Na2CO3溶液:C(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)]
B.0.1 mol/L NH4Cl溶液:C(NH4+ )=C(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:C(Na+)>C(CH3COO-)>C(H+)>C(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:C(Na+)>C(NO3-)
参考答案:A
本题解析:选项A符合物料守恒,正确。氯化铵溶液显酸性,所以根据电荷守恒可知,C(NH4+)<C(Cl-),B不正确。根据电荷守恒C(Na+)+C(H+)=C(CH3COO-)+C(OH-)可知,如果溶液显酸性,则C(CH3COO-)>C(Na+)>C(H+)>C(OH-),C不正确。由于硝酸钠溶液显中性,所以C(Na+)=C(NO3-),加入盐酸后二者仍然是相等的,D不正确,答案选A。
本题难度:困难
5、选择题 0.1 mol?L-1 KHS溶液中下列表达式不正确的是
A.c(K+)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-)
B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H +)
C.c(HS-)+ c(S2-)+ c(H2S)= 0.1 mol?L-1
D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c(H+)
参考答案:D
本题解析:A.溶液遵循电中性原则,即c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-),故A正确;B.溶液中存在水的电离,并且HS-水解程度大于HS-电离程度,则c(OH-)>c(H+),因水解程度较弱,则c(K+)>c(HS-)>c(OH-)>c(H+),又由于溶液中存在水的电离,则c(H+)>c(S2-),则溶液中正确的电离平衡为:c(K+)>c(HS-)>c(OH-)>c(H+)>c(S2-),故B错误;C.0.1mol?L-1KHS溶液中含有:HS-、S2-、H2S,由物料守恒可知c(HS-)+c(S2-)+c(H2S)=0.1 mol?L-1,故C正确;D.溶液中存在水的电离,并且HS-水解程度大于HS-电离程度,存在HS-?H++S2-,HS-+H2O?H2S+OH-,H2O?H++OH-,则c(OH-)>c(H2S)>c(H+),因水解程度较弱,则c(K+)>c(HS-)>c(OH-)>c(H2S)>c(H+),故D正确.
故选B.
考点:离子浓度的大小比较
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《硫及其化合.. | |