微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 “绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
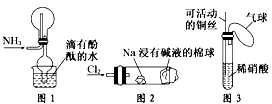
[? ]
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④
B.①②③
C.①②④
D.①③④
参考答案:C
本题解析:
本题难度:一般
2、选择题 以节能减排为基础的低碳经济是保持社会可持续发展的战略举措.下列做法违背发展低碳经济的是( )
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
参考答案:D
本题解析:
本题难度:一般
3、选择题 根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2↑
HgBr2+H2↑
③HgBr2+CaO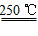 HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO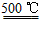 2Hg+O2↑
2Hg+O2↑
该方案的目的是为了制备
[? ]
A.HBr
B.CaO
C.H2
D.Hg
参考答案:C
本题解析:
本题难度:简单
4、填空题 海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。
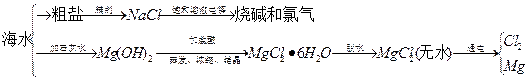 ?
?
根据示意图回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时所用试剂为盐 酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是?、?、?、?。
(2)电解饱和食盐水的总反应的化学方程式为?。
(3)工业上MgCl2·6H2O晶体在?气氛中加热脱水,通入此种气体的作用是?。
参考答案:(1)试剂的顺序是?NaOH溶液 ?、BaCl2溶液 、 Na2CO3溶液?、 盐 酸 ?。(各1分)
通电
本题解析:略
本题难度:简单
5、实验题 (13分)工业合成氨与制备硝酸一般可连续生产,流程如下:
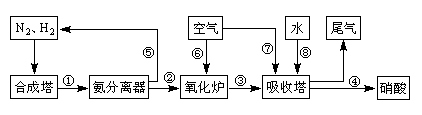
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g)?△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g)?△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
T/℃
| T1
| 300
| T2
|
K
| 1.00×107
| 2.45×105
| 1.88×103
|
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示。温度高于900℃时,NH3产率下降的原因?。

(4)在上述流程图中,氧化炉中发生反应的化学方程式为___________。
(5)硝酸厂的尾气直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g) +2H2O(g)?△H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式____________________,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是__________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_______________________。
参考答案:(1)1?(2)<?(3)温度高于900℃时,平衡向左移动。(4)
(5)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)?△H=-867kJ/mol
(6)4NH3+3O2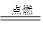 ?2N2+6H2O;负极;? 2NH3 — 6e- + 6OH- =N2 +6H2O
?2N2+6H2O;负极;? 2NH3 — 6e- + 6OH- =N2 +6H2O
本题解析:(1)起始时CO和水蒸气的物质的量浓度分别是0.2mol/L和0.3mol/L。平衡时氢气时0.12mol/L,所以生成CO2也是0.12mol/L,消耗CO和水蒸气都是0.12molL/L,因此平衡时CO和水蒸气的物质的量浓度分别是0.08mol/L和0.18mol/L,因此平衡常数K=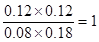 。
。
(2)因为是放热反应,所以升高温度,平衡向逆反应方向移动,平衡常数减小,所以T1<300℃。
(3)因为是放热反应,所以升高温度,平衡向逆反应方向移动,即温度高于900℃时,平衡向左移动,所以产率降低。
(4)氧化炉中发生的是氨的催化氧化,所以方程式为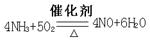 。
。
(5)考查盖斯定律的应用,(①+②)÷2即得到CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g),所以反应热是(-574kJ·mol-1-1160kJ·mol-1)÷2=-867kJ/mol。
(6)根据反应物和生成物可知,方程式为4NH3+3O2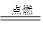 ?2N2+6H2O。氨气在反应中失去电子,所以在负极通入,电极反应式为2NH3 — 6e- + 6OH- =N2 +6H2O。
?2N2+6H2O。氨气在反应中失去电子,所以在负极通入,电极反应式为2NH3 — 6e- + 6OH- =N2 +6H2O。
本题难度:一般