微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 若使相同体积的NaCl、CaCl2、AlCl3中的Cl-完全沉淀,用去相同的物质的量浓度的AgNO3溶液的体积相同,则NaCl、CaCl2、AlCl3溶液的物质的量浓度之比是
[? ]
A.6:3:2
B.3:2:1
C.1:2:3
D.1:1:1
参考答案:A
本题解析:
本题难度:一般
2、选择题 已知向某溶液中逐滴加入NaOH溶液时,测得生成沉淀的质量随所加入NaOH的体积变化如图所示,则该溶液中大量含有的离子可能是
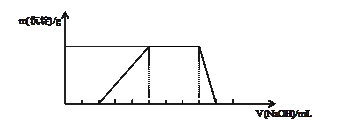
A.H+、NH4+、Al3+、NO3-
B.H+、Al3+、AlO2-、SO42-
C.H+、NH4+、Mg2+、Cl-
D.NH4+、Al3+、Cl-、SO42-
参考答案:A
本题解析:根据图像可知,开始不产生沉淀,说明溶液中含有氢离子,当沉淀最大时,继续加入氢氧化钠,沉淀不变化,但最终沉淀消失。且生成沉淀和溶解沉淀消耗的氢氧化钠是3︰1的,所以一定含有铝离子;所以选项A正确,CD不正确,B中离子不能大量共存,答案选A。
本题难度:一般
3、填空题 已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
(1)D的化学式是?,判断理由是?。
(2)写出其余几种物质的化学式:A?,B?,C?。
(3)写出实验②中有关反应的离子方程式?,?。
参考答案:(1)(NH4)2CO3? D和A、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,D只能为(NH4)2CO3?每空2分
(2)H2SO4? NaOH? Ba(NO3)2?每空2分
(3)NH4++OH- NH3↑+H2O,? NH3+H+=NH4+?每个方程式2分
NH3↑+H2O,? NH3+H+=NH4+?每个方程式2分
本题解析:结合题干已知条件根据①可知A、D中含SO42-、CO32的一种,C中含Ba2+,根据②③可知D和A、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,所以D只能为(NH4)2CO3,A中含SO42-也就只能是H2SO4。C为溶液,又含有Ba2+离子的只能是Ba(NO3)2?,剩余离子结合为NaOH,即B 则为NaOH.实验②中有关反应的离子方程式是略。
本题难度:一般
4、选择题 CO2通入到下列各溶液中不可能生成沉淀的是
A.饱和氯化钠溶液
B.石灰水
C.饱和碳酸钠溶液
D.硅酸钠溶液
参考答案:A
本题解析:A项中,因为弱酸不能和强酸盐发生复分解反应,二氧化碳通入到氯化钠溶液中不反应;B项中,二氧化碳与石灰水反应可以生成白色碳酸钙沉淀;C项中,向饱和碳酸钠溶液中通入二氧化碳的反应,生成的碳酸氢钠的溶解度比碳酸钠小,而生成的碳酸氢钠的质量却比碳酸钠大,因此必然有固体碳酸氢钠析出;D项中,因为碳酸的酸性强于硅酸,所以二氧化碳通入硅酸钠溶液中,会发生反应生成白色胶状硅酸沉淀.
本题难度:一般
5、选择题 下列说法正确的是
A.90℃时,纯水的pH等于7
B.已知一种c (H+)=1×10-3mol/L的酸和一种c (OH-)=1×10-3mol/L碱溶液以等体积混合后,溶液呈酸性,其原因是浓的弱酸和稀碱反应所致
C.配制FeCl3溶液,为了抑制水解,常加稀硫酸
D.在Na2S溶液中,离子浓度的关系是:c (Na+)>c (S2-)>c (HS-)>c (OH-)>c (H+)
参考答案:B
本题解析:A错,90℃时,纯水的pH小于7;B正确,若溶液呈酸性则该酸为越酸所致;C错,配制FeCl3溶液,为了抑制水解,常加稀盐酸;D错,离子浓度的关系是:c (Na+)>c (S2-)>c (OH-)>c (HS-)>c (H+)
本题难度:一般